Cos'è il Glaucoma?
Il glaucoma è una malattia del nervo ottico che rappresenta una delle più frequenti cause di cecità nel mondo (colpisce circa il 2% dei soggetti di età superiore ai 35 anni). La cecità legata al glaucoma si può quasi sempre prevenire purché la malattia sia diagnosticata e curata tempestivamente. Il danno delle fibre del nervo ottico è lento, progressivo ed asintomatico fino agli stadi terminali tanto che il glaucoma viene definito “killer silente”.
La conseguenza della malattia glaucomatosa è la perdita progressiva della visione periferica che procede se non trattato fino alla perdita della visione centrale. L’ipertensione oculare, coadiuvata da altri fattori che aumentano la vulnerabilità dei tessuti, inizia insidiosamente il danneggiamento del nervo ottico. Un certo numero di fibre entra in sofferenza sino ad essere distrutte. Se non viene istituita in tempo la terapia adatta ne consegue una progressiva lesione del nervo ottico (papilla ottica). In questa struttura la escavazione centrale che é presente anche in molti occhi normali va via via sempre più allargandosi a spese del tessuto nervoso normale. Nelle fasi avanzate la papilla ottica appare atrofica e caratteristicamente escavata detta “a pignatta”.
Tale affezione è familiare.
Cosa succede?
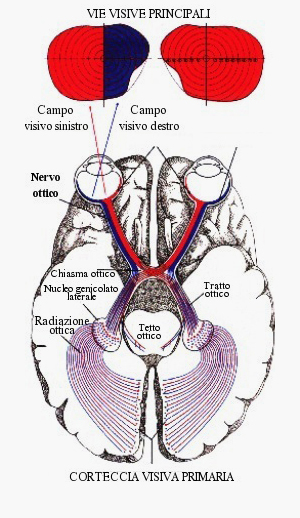
Quando fissiamo un oggetto percepiamo l’oggetto fissato insieme a tutto cio’ che lo circonda: l’area di spazio che viene percepita costituisce il campo visivo. L’immagine per essere percepita viene trasmessa dalla retina al cervello tramite il nervo ottico che si puo’ paragonare ad un cavo elettrico contenente milioni di “fili”. Ciascuno di questi “fili” porta le immagini relative ad una parte del campo visivo; tutte insieme queste parti costituiscono l’immagine nella sua interezza. L’aumento della pressione danneggia irreparabilmente questi “fili”. Inizialmente il danno interessa i fili che portano le immagini relative a porzioni periferiche del campo visivo: il paziente continua a vedere l’oggetto che fissa e non si accorge che l’area di spazio che globalmente percepisce si sta riducendo. Da ultimo vengono lesi anche i “fili” che provengono da quell’area della retina con cui si fissano gli oggetti e si ha la riduzione della acuita’ visiva fino alla cecita’ completa.
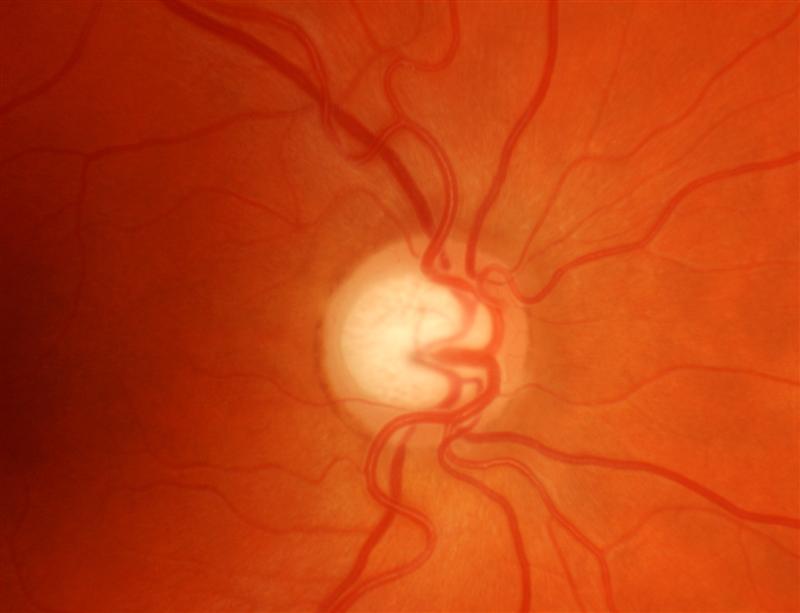
Il nervo ottico
l nervo ottico è il II nervo cranico e trasmette le informazioni visive dalla retina al cervello.
Il nervo ottico dal bulbo oculare lascia l’orbita e attraverso il canale ottico raggiunge il chiasma dove le fibre che lo compongono si incrociano; infatti, le fibre provenienti dalle emiretine nasali si incrociano e proseguono nel tratto ottico controlaterale raggiungendo il mesencefalo la corteccia visiva, area ottica primaria nel lobo occipitale (area 17).
In base ai rapporti che il nervo ottico contrae, il suo decorso è distinto in 4 parti:
- Parte intrabulbare: attraverso membrana coroidea e sclera dell’occhio
- Parte intraorbitaria: dal polo posteriore dell’occhio al foro ottico dello sfenoide
- Parte intracanalicolare: attraverso il foro ottico dello sfenoide
- Parte intracranica: dal foro ottico dello sfenoide giunge al chiasma ottico
Vi sono tre tipi di fibre ottiche:
- Maculari: al chiasma metà fibre incrociano, l’altra metà prosegue diretta
- Nasali: si incrociano totalmente
- Temporali: non incrociano e continuano dirette
Una lesione a carico del nervo ottico produce una perdita permanente dell’acuità visiva.
Prevenzione
Nella maggior parte dei casi la diagnosi di glaucoma viene fatta del tutto casualmente nel corso di una visita effettuata per altri disturbi, o per controllo e non è raro che questa avvenga quando la situazione è già avanzata. Il danno causato dal glaucoma è irreversibile. E’ per questi motivi fondamentale la diagnosi precoce. Tutti gli individui sopra i 40 anni di età dovrebbero sottoporsi ad una visita oculistica una volta l’anno con controllo della pressione oculare e del fundus oculi. In caso di familiarità si consigliano controlli periodici in età più precoce.
Fattori di rischio
La classificazione del glaucoma
L’80% delle forme di glaucoma sono dette ad angolo aperto (glaucoma primario ad angolo aperto) in cui si assiste ad una progressiva degenerazione del nervo ottico in presenza di valori di pressione oculare elevati in assenza di alterazioni anatomiche macroscopiche che possano giustificare tale innalzamento. In percentuale molto inferiore sono i casi di “glaucomi a pressione normale”. In questi casi si assiste ad un progressivo deterioramento del nervo ottico con alterazioni del campo visivo in assenza di valori di pressione oculare elevati. Si ha un glaucoma primario ad angolo aperto ma stretto in cui l’aumento della pressione oculare può essere attribuito alla chiusura anatomica, parziale (glaucoma cronico ad angolo stretto) o totale (attacco di glaucoma acuto), delle vie discarico dell’umore acqueo. Il glaucoma secondario fa invece riferimento a tutte quelle forme di glaucoma in cui è identificabile una causa precisa responsabile dell’aumento della pressione oculare. Tra le numerose forme di glaucoma secondario ricordiamo il glaucoma pseudoesfoliativo, il glaucoma pigmentario, il glaucoma da cortisone, il glaucoma post-traumatico ed il glaucoma neovascolare (spesso associato al diabete o a problematiche vascolari della retina).
L'ipertensione oculare
La pressione normale è in media 16 mmHg. In base a considerazioni statistiche il limite superiore della pressione normale si considera 21 mmHg. La presenza di una pressione intraoculare normale permette il mantenimento della forma del bulbo e il normale funzionamento dei processi fisiologici oculari. Nell’occhio esistono meccanismi di regolazione che tendono a mantenere più o meno costante il limite della pressione intraoculare. Si parla di ipertensione oculare in presenza di valori di pressione oculare superiori a 21-22 mmHg in assenza di danno del nervo ottico o del campo visivo. Chi ha una pressione degli occhi elevata ha un maggior rischio di sviluppare il glaucoma. La decisione di iniziare o meno una terapia va presa d’accordo con il proprio oculista in base alla valutazione completa dei fattori di rischio individua i
Monitoraggio della malattia
Trattandosi di una patologia cronica è fondamentale il monitoraggio della malattia che viene effettuato mediante visite oculistiche periodiche che includono l’esame diretto dell’aspetto del nervo ottico, la misurazione della pressione oculare (tonometria), l’esecuzione di esami computerizzati per lo studio del nervo ottico e delle fibre nervose che lo costituiscono (HRT, GDx, OCT) e l’esame del campo visivo. E’ opportuno sottolineare che la metodica di riferimento per la misurazione della pressione oculare è la tonometria ad applanazione di Goldmann. Altre forme di tonometria (es. tonometria a soffio) non hanno la stessa accuratezza e pertanto non possono essere considerate sostitutive della tonometria ad applanazione. La frequenza delle visite e degli esami può variare notevolmente a seconda delle necessità individuali. Si consiglia l’esecuzione di almeno 6 campi visivi computerizzati nei primi 2 anni dalla diagnosi per inquadrare la velocità con cui la malattia tende a progredire nel singolo paziente, informazione utile a fini prognostici e terapeutici.
La terapiadel glaucoma
Lo scopo della terapia del glaucoma in termini generali è di preservare la funzione visiva del paziente e la relativa qualità di vita. Questo significa rallentare il naturale decorso della malattia ad un livello tale da minimizzare l’impatto della progressione del danno funzionale sulla qualità di vita del singolo paziente. La terapia ipotonizzante oculare, sia essa medica, laser o chirurgica mira a ridurre il rischio di progressione del glaucoma. E’ chiaro a questo punto che la scelta dell’approccio terapeutico deve tener conto delle necessità individuali di ridurre il rischio e rallentare la velocità di progressione e l’aggressività del trattamento (da una efficace monoterapia a terapie d’associazione alla terapia medica massimale fino alla scelta chirirgica) dovrà tenere conto di queste necessità.
La terapia medica si avvale di numerosi principi attivi che usati da soli o in associazione tra di loro permettono di ridurre la pressione oculare o riducendo la produzione di umore acqueo all’interno dell’occhio (beta-bloccanti, alfa-agonisti, inibitori dell’anidrasi carbonica) o favorendone il deflusso (analoghi prostaglandinici, pilocarpina).
La dinamica dell’umore acqueo e la pressione intraoculare dell’occhio glaucomatoso può essere affrontata in quattro modi con terapie topiche (colliri):
- secrezione dell’acqueo (beta-bloccanti, inibitori dell’anidrasi carbonici, alfa2-agonisti)
- deflusso trabecolare (miotici, epinefrina)
- deflusso uveo-sclerale (analoghi delle prostaglandine)
- pressione episclerale venosa/perfusione del corpo ciliare (alfa-2-agonisti con proprietà alfa-1-agonistiche).
La terapia parachirurgica si avvale di laser che vengono impiegati in caso di angolo irido-cornale (angolo di drenaggio) stretto per favorire il deflusso dell’umore acqueo (trabeculoplastica laser) o in caso di angolo di drenaggio stretto per favorirne l’apertura (iridoplastica periferica, iridotomia).
Il laser YAG al neodimio viene usato per praticare iridotomie, indicate nelle forme da chiusura d’angolo.
Il laser ad Argon ed altri laser termici vengono invece impiegati soprattutto per praticare la Trabeculoplastica, indicata nelle forme ad Angolo Aperto e la gonioplastica di uso più raro.
La terapia chirurgica ha comunque lo scopo di ridurre la pressione oculare creando delle vie di deflusso alternative ai liquidi intraoculare.Esistono diverse tecniche chirurgiche, sia penetranti sia non penetranti, con differenti indicazioni in base al tipo di glaucoma. La scelta dipende dall’obiettivo pressorio richiesto, da precedenti trattamenti (farmaci, altra chirurgia), da rischi particolari (per es., soggetto monocolo).La trabeculectomia è l’intervento di scelta nel glaucoma ad angolo aperto. Dopo l’apertura della congiuntiva bulbare, si crea uno sportello sclerale e si asporta un tassello di trabecolato. Lo sportello viene quindi riadagiato, suturato e la congiuntiva richiusa perfettamente. Lo scopo di tale intervento è di creare una fistola ’protetta‘, una nuova via di drenaggio che consenta all’umor acqueo di fluire dalla camera anteriore dell’occhio allo spazio sottocongiuntivale, oltrepassando il trabecolato, la sede dove in questa forma di glaucoma si verifica l’ostacolo al deflusso. Questo processo di filtrazione determina un sollevamento della congiuntiva nella sede chirurgica (bozza filtrante), la cui presenza indica il buon esito dell’intervento. Le complicanze a breve termine includono emorragie, infiammazione della camera anteriore, filtrazione eccessiva con conseguente ipotonia, camera anteriore ridotta o abolita, distacco di coroide. Tra i rischi a lungo termine si sottolineano un’accelerata progressione della cataratta e il rischio di infezione della bozza filtrante, evento che può portare ad un’endoftalmite con potenziali gravi conseguenze per la vista. Nei casi in cui la trabeculectomia ha una bassa probabilità di riuscita si fa uso di impianti drenanti, sistemi valvolari dotati di un tubicino posizionato nella camera anteriore dell’occhio. La sclerectomia profonda è un intervento filtrante non perforante. Questo intervento ha minori complicanze della trabeculectomia. Con questa tecnica la filtrazione dell’umor acqueo dalla camera anteriore allo spazio sottocongiuntivale avviene attraverso una sottile lamella della cornea lasciata in sede. Questa membrana presenta una resistenza al deflusso dell’umore acqueo moderata ma costante, e permette di evitare il brusco calo della pressione intraocular che spesso si osserva in corso di trabeculectomia. Tuttavia i risultati a lungo termine sono spesso inferiori a quelli conseguiti con l’intervento di trabeculectomia.
Nei casi refrattari alla terapia chirurgica convenzionale trovano applicazione gli impianti drenanti o valvole (tipo Baerveldt, Ahmed, Molteno, Express etc.) che prevedono la creazione di una via di drenaggio artificiale dei liquidi intraoculari).