Cos'è il Glaucoma?
Il glaucoma è una malattia del nervo ottico che rappresenta una delle più frequenti cause di cecità nel mondo (colpisce circa il 2% dei soggetti di età superiore ai 35 anni). La cecità legata al glaucoma si può quasi sempre prevenire purché la malattia sia diagnosticata e curata tempestivamente. Il danno delle fibre del nervo ottico è lento, progressivo ed asintomatico fino agli stadi terminali tanto che il glaucoma viene definito “killer silente”.
La conseguenza della malattia glaucomatosa è la perdita progressiva della visione periferica che procede se non trattato fino alla perdita della visione centrale. L’ipertensione oculare, coadiuvata da altri fattori che aumentano la vulnerabilità dei tessuti, inizia insidiosamente il danneggiamento del nervo ottico. Un certo numero di fibre entra in sofferenza sino ad essere distrutte. Se non viene istituita in tempo la terapia adatta ne consegue una progressiva lesione del nervo ottico (papilla ottica). In questa struttura la escavazione centrale che é presente anche in molti occhi normali va via via sempre più allargandosi a spese del tessuto nervoso normale. Nelle fasi avanzate la papilla ottica appare atrofica e caratteristicamente escavata detta “a pignatta”.
Tale affezione è familiare.
Cosa succede?
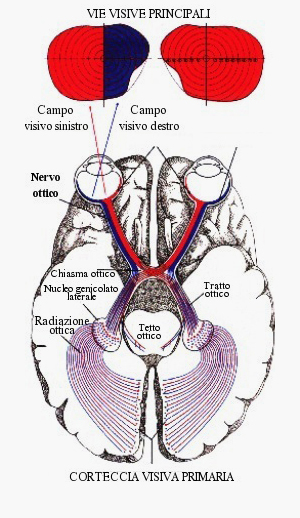
Quando fissiamo un oggetto percepiamo l’oggetto fissato insieme a tutto cio’ che lo circonda: l’area di spazio che viene percepita costituisce il campo visivo. L’immagine per essere percepita viene trasmessa dalla retina al cervello tramite il nervo ottico che si puo’ paragonare ad un cavo elettrico contenente milioni di “fili”. Ciascuno di questi “fili” porta le immagini relative ad una parte del campo visivo; tutte insieme queste parti costituiscono l’immagine nella sua interezza. L’aumento della pressione danneggia irreparabilmente questi “fili”. Inizialmente il danno interessa i fili che portano le immagini relative a porzioni periferiche del campo visivo: il paziente continua a vedere l’oggetto che fissa e non si accorge che l’area di spazio che globalmente percepisce si sta riducendo. Da ultimo vengono lesi anche i “fili” che provengono da quell’area della retina con cui si fissano gli oggetti e si ha la riduzione della acuita’ visiva fino alla cecita’ completa.
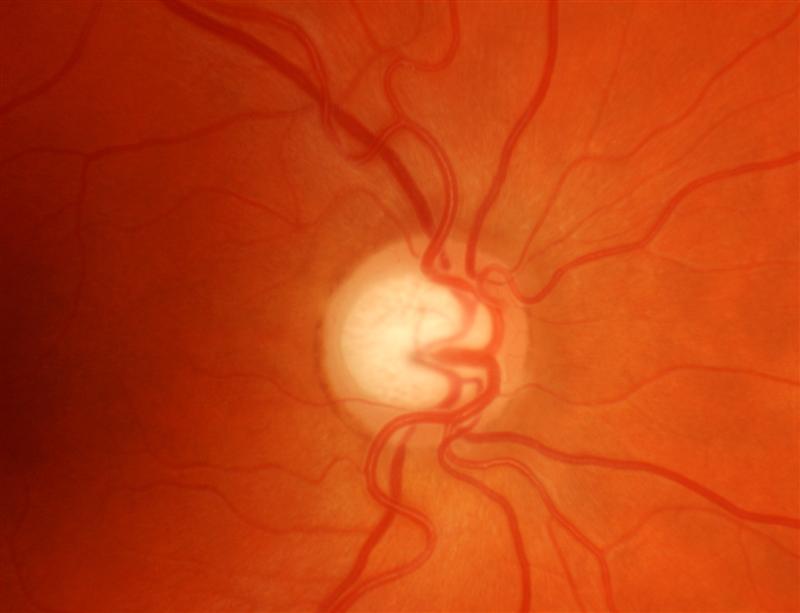
Il nervo ottico
l nervo ottico è il II nervo cranico e trasmette le informazioni visive dalla retina al cervello.
Il nervo ottico dal bulbo oculare lascia l’orbita e attraverso il canale ottico raggiunge il chiasma dove le fibre che lo compongono si incrociano; infatti, le fibre provenienti dalle emiretine nasali si incrociano e proseguono nel tratto ottico controlaterale raggiungendo il mesencefalo la corteccia visiva, area ottica primaria nel lobo occipitale (area 17).
In base ai rapporti che il nervo ottico contrae, il suo decorso è distinto in 4 parti:
- Parte intrabulbare: attraverso membrana coroidea e sclera dell’occhio
- Parte intraorbitaria: dal polo posteriore dell’occhio al foro ottico dello sfenoide
- Parte intracanalicolare: attraverso il foro ottico dello sfenoide
- Parte intracranica: dal foro ottico dello sfenoide giunge al chiasma ottico
Vi sono tre tipi di fibre ottiche:
- Maculari: al chiasma metà fibre incrociano, l’altra metà prosegue diretta
- Nasali: si incrociano totalmente
- Temporali: non incrociano e continuano dirette
Una lesione a carico del nervo ottico produce una perdita permanente dell’acuità visiva.
Prevenzione
Nella maggior parte dei casi la diagnosi di glaucoma viene fatta del tutto casualmente nel corso di una visita effettuata per altri disturbi, o per controllo e non è raro che questa avvenga quando la situazione è già avanzata. Il danno causato dal glaucoma è irreversibile. E’ per questi motivi fondamentale la diagnosi precoce. Tutti gli individui sopra i 40 anni di età dovrebbero sottoporsi ad una visita oculistica una volta l’anno con controllo della pressione oculare e del fundus oculi. In caso di familiarità si consigliano controlli periodici in età più precoce.
Fattori di rischio
La classificazione del glaucoma
L’80% delle forme di glaucoma sono dette ad angolo aperto (glaucoma primario ad angolo aperto) in cui si assiste ad una progressiva degenerazione del nervo ottico in presenza di valori di pressione oculare elevati in assenza di alterazioni anatomiche macroscopiche che possano giustificare tale innalzamento. In percentuale molto inferiore sono i casi di “glaucomi a pressione normale”. In questi casi si assiste ad un progressivo deterioramento del nervo ottico con alterazioni del campo visivo in assenza di valori di pressione oculare elevati. Si ha un glaucoma primario ad angolo aperto ma stretto in cui l’aumento della pressione oculare può essere attribuito alla chiusura anatomica, parziale (glaucoma cronico ad angolo stretto) o totale (attacco di glaucoma acuto), delle vie discarico dell’umore acqueo. Il glaucoma secondario fa invece riferimento a tutte quelle forme di glaucoma in cui è identificabile una causa precisa responsabile dell’aumento della pressione oculare. Tra le numerose forme di glaucoma secondario ricordiamo il glaucoma pseudoesfoliativo, il glaucoma pigmentario, il glaucoma da cortisone, il glaucoma post-traumatico ed il glaucoma neovascolare (spesso associato al diabete o a problematiche vascolari della retina).
L'ipertensione oculare
La pressione normale è in media 16 mmHg. In base a considerazioni statistiche il limite superiore della pressione normale si considera 21 mmHg. La presenza di una pressione intraoculare normale permette il mantenimento della forma del bulbo e il normale funzionamento dei processi fisiologici oculari. Nell’occhio esistono meccanismi di regolazione che tendono a mantenere più o meno costante il limite della pressione intraoculare. Si parla di ipertensione oculare in presenza di valori di pressione oculare superiori a 21-22 mmHg in assenza di danno del nervo ottico o del campo visivo. Chi ha una pressione degli occhi elevata ha un maggior rischio di sviluppare il glaucoma. La decisione di iniziare o meno una terapia va presa d’accordo con il proprio oculista in base alla valutazione completa dei fattori di rischio individua i
Monitoraggio della malattia
Trattandosi di una patologia cronica è fondamentale il monitoraggio della malattia che viene effettuato mediante visite oculistiche periodiche che includono l’esame diretto dell’aspetto del nervo ottico, la misurazione della pressione oculare (tonometria), l’esecuzione di esami computerizzati per lo studio del nervo ottico e delle fibre nervose che lo costituiscono (HRT, GDx, OCT) e l’esame del campo visivo. E’ opportuno sottolineare che la metodica di riferimento per la misurazione della pressione oculare è la tonometria ad applanazione di Goldmann. Altre forme di tonometria (es. tonometria a soffio) non hanno la stessa accuratezza e pertanto non possono essere considerate sostitutive della tonometria ad applanazione. La frequenza delle visite e degli esami può variare notevolmente a seconda delle necessità individuali. Si consiglia l’esecuzione di almeno 6 campi visivi computerizzati nei primi 2 anni dalla diagnosi per inquadrare la velocità con cui la malattia tende a progredire nel singolo paziente, informazione utile a fini prognostici e terapeutici.
La terapiadel glaucoma
Lo scopo della terapia del glaucoma in termini generali è di preservare la funzione visiva del paziente e la relativa qualità di vita. Questo significa rallentare il naturale decorso della malattia ad un livello tale da minimizzare l’impatto della progressione del danno funzionale sulla qualità di vita del singolo paziente. La terapia ipotonizzante oculare, sia essa medica, laser o chirurgica mira a ridurre il rischio di progressione del glaucoma. E’ chiaro a questo punto che la scelta dell’approccio terapeutico deve tener conto delle necessità individuali di ridurre il rischio e rallentare la velocità di progressione e l’aggressività del trattamento (da una efficace monoterapia a terapie d’associazione alla terapia medica massimale fino alla scelta chirirgica) dovrà tenere conto di queste necessità.
La terapia medica si avvale di numerosi principi attivi che usati da soli o in associazione tra di loro permettono di ridurre la pressione oculare o riducendo la produzione di umore acqueo all’interno dell’occhio (beta-bloccanti, alfa-agonisti, inibitori dell’anidrasi carbonica) o favorendone il deflusso (analoghi prostaglandinici, pilocarpina).
La dinamica dell’umore acqueo e la pressione intraoculare dell’occhio glaucomatoso può essere affrontata in quattro modi con terapie topiche (colliri):
- secrezione dell’acqueo (beta-bloccanti, inibitori dell’anidrasi carbonici, alfa2-agonisti)
- deflusso trabecolare (miotici, epinefrina)
- deflusso uveo-sclerale (analoghi delle prostaglandine)
- pressione episclerale venosa/perfusione del corpo ciliare (alfa-2-agonisti con proprietà alfa-1-agonistiche).
La terapia parachirurgica si avvale di laser che vengono impiegati in caso di angolo irido-cornale (angolo di drenaggio) stretto per favorire il deflusso dell’umore acqueo (trabeculoplastica laser) o in caso di angolo di drenaggio stretto per favorirne l’apertura (iridoplastica periferica, iridotomia).
Il laser YAG al neodimio viene usato per praticare iridotomie, indicate nelle forme da chiusura d’angolo.
Il laser ad Argon ed altri laser termici vengono invece impiegati soprattutto per praticare la Trabeculoplastica, indicata nelle forme ad Angolo Aperto e la gonioplastica di uso più raro.
La terapia chirurgica ha comunque lo scopo di ridurre la pressione oculare creando delle vie di deflusso alternative ai liquidi intraoculare.Esistono diverse tecniche chirurgiche, sia penetranti sia non penetranti, con differenti indicazioni in base al tipo di glaucoma. La scelta dipende dall’obiettivo pressorio richiesto, da precedenti trattamenti (farmaci, altra chirurgia), da rischi particolari (per es., soggetto monocolo).La trabeculectomia è l’intervento di scelta nel glaucoma ad angolo aperto. Dopo l’apertura della congiuntiva bulbare, si crea uno sportello sclerale e si asporta un tassello di trabecolato. Lo sportello viene quindi riadagiato, suturato e la congiuntiva richiusa perfettamente. Lo scopo di tale intervento è di creare una fistola ’protetta‘, una nuova via di drenaggio che consenta all’umor acqueo di fluire dalla camera anteriore dell’occhio allo spazio sottocongiuntivale, oltrepassando il trabecolato, la sede dove in questa forma di glaucoma si verifica l’ostacolo al deflusso. Questo processo di filtrazione determina un sollevamento della congiuntiva nella sede chirurgica (bozza filtrante), la cui presenza indica il buon esito dell’intervento. Le complicanze a breve termine includono emorragie, infiammazione della camera anteriore, filtrazione eccessiva con conseguente ipotonia, camera anteriore ridotta o abolita, distacco di coroide. Tra i rischi a lungo termine si sottolineano un’accelerata progressione della cataratta e il rischio di infezione della bozza filtrante, evento che può portare ad un’endoftalmite con potenziali gravi conseguenze per la vista. Nei casi in cui la trabeculectomia ha una bassa probabilità di riuscita si fa uso di impianti drenanti, sistemi valvolari dotati di un tubicino posizionato nella camera anteriore dell’occhio. La sclerectomia profonda è un intervento filtrante non perforante. Questo intervento ha minori complicanze della trabeculectomia. Con questa tecnica la filtrazione dell’umor acqueo dalla camera anteriore allo spazio sottocongiuntivale avviene attraverso una sottile lamella della cornea lasciata in sede. Questa membrana presenta una resistenza al deflusso dell’umore acqueo moderata ma costante, e permette di evitare il brusco calo della pressione intraocular che spesso si osserva in corso di trabeculectomia. Tuttavia i risultati a lungo termine sono spesso inferiori a quelli conseguiti con l’intervento di trabeculectomia.
Nei casi refrattari alla terapia chirurgica convenzionale trovano applicazione gli impianti drenanti o valvole (tipo Baerveldt, Ahmed, Molteno, Express etc.) che prevedono la creazione di una via di drenaggio artificiale dei liquidi intraoculari).
Distacchi
Cos'è il distacco?
Quando la retina si distacca dalla parete interna dell’occhio vi è una perdita delle capacità visive, rendendo l’occhio cieco in quel determinato settore. Se la retina resta staccata per molto tempo il recupero visivo dopo l’intervento chirurgico sarà scarso o nullo.
Quindi la tempestività della diagnosi e dell’intervento è elemento di estrema importanza per il recupero della funzione visiva.
Esistono 3 tipologie di distacco di retina:
- Il distacco di retina regmatogeno, che è il più frequente, è dovuto ad una rottura della retina che permette al vitreo (la sostanza gelatinosa che occupa l’interno dell’occhio) di passare attraverso al foro scollando progressivamente la retina
- Il distacco di retina trazionale, è generato da briglie di tessuto fibro-vascolare, formate all’interno della cavità vitreale, che esercitano una trazione centrifuga sulla retina che viene strappata e da quei fori anche se piccoli può iniziere un distacco di retina: il caso più frequente è in corso di retinopatia diabetica.
- Il distacco di retina essudativo è di solito dovuto ad essudazione di liquido che si posiziona sotto la retina scollandola ed è dovuto per lo più di tumori primitivi o secondari( metastasi) o da infiammazioni oculari (uveiti).
Distacco di retina regmatogeno
Per spiegare il perché della formazione delle rotture retiniche è necessario tenere presente che il vitreo, per sua natura gelatinoso, può per diverse cause denaturarsi divenendo più fluido (degenerazione da gel in sol), verificandosi il cosiddetto distacco posteriore di vitreo. Tale processo non è subito “completo”. Ne risulta che la porzione liquefatta non ha aderenza con la parete interna retinica, creando uno spostamento della massa vitreale a carico della porzione ancora gelificata. Questa rimanendo saldamente aderente e non avendo più un supporto crea una trazione che può lacerare la retina. Fortunatamente la grande maggioranza dei distacchi posteriori di vitreo non causano una rottura della retina e quindi non esitano in un distacco di retina. Pertanto un distacco di retina può verificarsi in conseguenza di una rottura retinica. In tal caso il vitreo passa attraverso la rottura e scolla la retina che si stacca prima parzialmente e poi totalmente. I sintomi del distacco di retina, non sempre però avvertibili, sono: visione di flash luminosi, di corpi mobili (le cosiddette mosche volanti); a questi si aggiunge una visione di “tenda scura ” quando c’è il distacco di retina conclamato. E’ superfluo dire che la prevenzione del distacco di retina è essenziale. Essa si basa su visite periodiche, soprattutto in presenza di sintomi e nei soggetti miopi che presentano un ulteriore fattore di rischio perché spesso hanno in periferia delle aree di minor resistenza o di alterazioni ; l’esame del fondo dell’occhio può rilevare la presenza di rotture o aree di debolezza del tessuto retinico, che talora impongono un trattamento laser. Questo è mirato a barrare la zona a rischio crando uno sbarramento della lesione, cioè a rinforzare la retina attorno alla rottura, cicatrizzandola prima che il liquido passi dietro la retina scollandola.
Distacco di retina tradizionale
Nel distacco trazionale sono presenti membrane fibrose o fibrovascolari nel vitreo che esercitano una trazione sulla retina distaccandola. La causa più comune è la retinopatia diabetica proliferante; in questi casi crescono vasi anomali (neovasi) sulla superficie della retina che si aggettano nel corpo vitreo, causando spesso emorragie che intorbidano la vista. Un’altra causa del DR trazionale è la proliferazione vitreo-retinica che può complicare un precedente intervento di distacco di retina regmatogeno.
Distacco di retina essudativo
Nel distacco di retina essudativo, non esistendo una rottura, il fluido crea una di raccolta di liquido che mantiene sollevata la retina. Le cause possono essere individuate in tumori (es. melanoma della coroide), malattie infiammatorie (uveite), anomalie congenite (es. nanoftalmo, malattia di Coats) o malattie degenerative maculari. In tali casi, per una accurata diagnosi, si impone, oltre ad un attento esame oculistico, anche una ecografia ed una fluorangiografico.
Il trattamento e la prognosi sono quelli della malattia di base. Il recupero visivo dopo tali interventi è di difficile quantificazione e dipende soprattutto dallo stato retinico precedente l’intervento; è necessario comunque sottolineare che esistono casi talmente complicati che neanche le migliori e moderne tecniche chirurgiche riescono a risolvere.
In conclusione possiamo affermare che il distacco della retina è sempre un evento clinico estremamente temibile, anche al giorno d’oggi, benché la tecnica chirurgica sia estremamente progredita. Appare sempre più importante valutare i soggetti a rischio ed effettuare una prevenzione laser o chirurgica per evitare conseguenze estreme.
Terapia chirurgica
Una volta che il distacco di retina si è verificato, la terapia è solamente chirurgica.
Attualmente esistono tre differenti procedimenti chirurgici:
- il cerchiaggio e/o piombaggio sclerale,
- la vitrectomia,
- la retinopessia con gas
Chirurgia ab esterno
Il cerchiaggio e/o piombaggio sclerale è la terapia chirurgica più antica utilizzata in caso di distacco di retina regmatogeno. Il trattamento di effettua localizzando e poi trattando con il freddo (crioterapia) la/le rotture della retina, associandovi un cerchiaggio circonferenziale o a settore (piombaggio) mediante una bandelletta o una spugna di silicone. Questo crea una introflessione della retina nella zona della rottura permetterndo agli strati retinici di aderire l’un l’altroo Per accelerare il riaccollamento si evacua il liquido sottoretinico che ha creato il distacco di retina con una puntura nella zona in cui il distacco è più bolloso. Questa chirurgia può essere eseguita in anestesia locale o anestesia generale.
La Vitrectomia
Nel distacco di retina regmatogeno, la vitrectomia viene effettuata soprattutto se presenti trazioni vitreali od emorragie vitreali. L’intervento si effettua ab interno, entrando cioè nell’occhio, mediante degli appositi strumenti si scollano e si tagliano tutte le aderenze e al termine dell’intervento si introducono dei gas o dell’olio di silicone con loscopo di tenere ben distesa ed attaccata la retina.
Descrizione dell’intervento
La vitrectomia consiste nell’asportazione chirurgica di tutto o parte dell’umor vitreo. Questo intervento si avvale di sofisticatissimi strumenti della microchirurgia.
Tali strumenti consistono in un dispositivo miniaturizzato, chiamato ‘vitrectomo’, che taglia e rimuove il vitreo, aspirandolo, di unafibra ottica e di una linea di infusione che trasporta una soluzione fisiologica salina all’interno dell’occhio per mantenerne il tono man mano che il vitreo viene rimosso. Questi tre strumenti sono inseriti nell’occhio mediante piccole incisioni che vengono fatte nell’esterno del bulbo oculare, in una zona chiamata ‘pars-plana’.
L’intervento procede mediante l’uso di un particolare microscopio operatorio che consente al chirurgo, in unione all’illuminatore interno, di avere una visione ingrandita del complesso vitreo-retina. Così, con grande precisione si rimuove il vitreo ed eventualmente anche le membrane preretiniche come il cellophane ed il pucker maculare presenti sulla superficie retinica.
Terminato l’intervento, dopo un breve periodo di tempo, la soluzione fisiologica viene sostituita con l’umore acqueo, in modo naturale, dall’occhio stesso. L’umore acqueo, a contrario dell’umor vitreo, viene continuamente prodotto dai corpi cigliati e quindi non consente piu’ la formazione di opacita’ vitreali.
L’intervento viene solitamente praticato in anestesia locale peribulbare o generale,
Nel periodo successivo all’intervento stesso, il paziente deve seguire dei particolari accorgimenti, fra i quali, l’instillazione di particolari colliri, seguire certe posture per il sonno, evitare gli sforzi e i traumi.
Nel giro di qualche mese, salvo complicazioni, l’occhio riacquista gradualmente acuità visiva
Molto spesso tale intervento richiede l’utilizzo contemporaneo:
- Questo laser consente si saldare eventuali fori retinici, trattare proliferazioni anormali di vasi sanguigni e fermare emorragie. Questo tipo di tecnica e’ particolarmente utile per trattare le complicazioni oculari dei pazienti diabetici.
- Iniezione di aria e/o di gas. L’aria o il gas permettono di chiudere questi fori retinici e di mantenere piana la retina riattaccata al proprio posto. Tale gas, dopo un periodo di tempo variabile, si riassorbe e viene rimpiazzato dai normali fluidi dell’occhio, che attuano la stessa funzione del vitreo che e’ stato rimosso.
- Iniezione di olio di silicone. In alcuni casi si rende necessario sostenere la retina riattaccata mediante olio di silicone. Quest’ultima e’ una sostanza inerte che e’ piu’ efficace dell’aria o del gas nel mantenere in piano la retina. Talvolta puo’ rimanere nell’occhio permolto tempo, anche se quando è possibile si preferisce asportarla dopo alcuni mesi in quanto puo’ dare origine a tutta una serie di complicazioni, quali scompenso corneale e glaucoma.
La retinopessia con gas
Ipovisione
Cos'è l'ipovisione?
Molti pazienti con una vista molto bassa possono essere aiutati. Esistono oggi dei sistemi ottici ed elettronici che, ingrandendo le immagini, possono consentire una certa autonomia per la visione da vicino. Questi sistemi devono essere prescritti da oculisti esperti e talora vengono organizzati dei corsi di riabilitazione che insegnano al paziente l’utilizzo di tali strumenti.
Patologie vascolari retiniche
Cos'è l'occlusione arteriosa retinica?
L’occlusione arteriosa retinica è un evento drammatico che nella maggioranza dei casi porta alla perdita totale della capacità visiva di un occhio. L’occlusione arteriosa crea una impossibilità di apporto di sangue alla retina dell’occhio colpito, con fenomeni ischemici e di grave danno della funzione visiva. L’occlusione arteriosa è un evento drammatico, sia per le gravi alterazioni visive , sia perché è spesso o meglio sempre la manifestazione oculare di una patologia sistemica, (una sorta di campanello d’allarme); è conseguentemente necessario effettuare indagini strumentali:
- Eco-color-doppler dei tronchi sovra-aortici (TSA) e carotidei
- Eco-cardiogramma
- Monitoraggio della pressione arteriosa delle 24 ore (M.A.P.)
- una accurata valutazione dallo specialista cardiologo
- una routine ematica con controllo dei parametri della coagulazione
- una accurata valutazione dallo specialista ematologo
- cercare sempre la patologia sistemica responsabile dell’occlusione arteriosa retinica.
Diagnosi
L’esame del fundus oculi è estremamente indicativo e detto a “macula a rosso ciliegia”
Terapia
La terapia delle occlusioni arteriose retiniche deve essere avviata molto precocemente, meglio se entro poche ore, è comunque purtroppo raramente efficace. Il trattamento locale si attua per ottenere una variazione della pressione a livello della arteria centrale della retina e per cercare di mobilizzare l’embolo presente. Si deve praticare subito
- un massaggio del bulbo oculare per 2-5 minuti
- una paracentesi della camera anteriore
- iniezione retro-bulbare di farmaci vasodilatatori ed antispastici
- posizionare il paziente in maniera da ottenere una importante diminuzione della pressione arteriosa
- instaurare un trattamento sistemico con Acetazolamide, farmaci anticoagulanti, farmaci fibrinolitici
L’occlusione arteriosa può interessare il tronco arterioso principale (occlusione dell’arteria centrale della retina) oppure solo ramo (occlusione arteriosa di branca). Occlusione dell’arteria centrale della retina. È la forma di occlusione arteriosa retinica più frequente. Gli uomini sono più colpiti rispetto alle donne, l’età media è intorno ai 60 anni.
Le cause più comuni sono rappresentate da microemboli o emboli che si posizionano nell’arteria centrale della retina conseguenti a placche occlusive, spasmi vascolari, aneurismi dissecanti o necrosi arteriolare da ipertensione.
L’occlusione dell’arteria centrale della retina (O.A.C.R.) si associa ed è più frequente in pazienti che soffrono già di altre patologie vascolari sistemiche quali ad esempio l’ipertensione arteriosa, il diabete mellito, la stenosi carotidea e le valvulopatie cardiache. Il paziente lamenta un’improvvisa grave riduzione monolaterale dell’acuità visiva (amaurosi) senza alcun dolore, la pupilla appare dilatata (midriasi monolaterale), non riflette alla illuminazione diretta, ma è presente il riflesso consensuale quando si illumina l’altro occhio. L’esame del campo visivo computerizzato non si riesce solitamente ad eseguire. All’esame del Fundus Oculi la retina appare edematosa e di colorito pallido – biancastro sulla quale spicca una macchia rosso-ciliegia in corrispondenza della parte centrale della retina: la fovea (segno patognomonico). L’Edema retinico è maggiore nei casi di occlusione completa dell’arteria centrale della retina.
La fluorangiografia è sempre utile nel mostrare ed evidenziare la diagnosi di Occlusione dell’arteria centrale retinica e soprattutto per stabilire il grado di occlusione presente che si caratterizza in un ritardo più o meno marcato di riempimento dei vasi arteriosi.
La prognosi per la funzione visiva è davvero scarsa e la vista è spesso se sono sempre ridotta a pochissimo: conta delle dita – motu manu (movimento della mano), percezione luce. Il Fondo Oculare si presenta nei giorni successivi all’occlusione in maniera diversa a seconda ed in rapporto alla ri – perfusione del circolo arterioso retinico. Si assiste in genere ad una progressiva diminuzione dell’edema retinico e nelle settimane successive compare spesso un’atrofia ottica a settore della testa del nervo ottico ed un restringimento dei vasi arteriosi.
Le complicanze a lungo termine quali le proliferazioni di capillari anomali retinici o papillari e l’insorgenza di glaucoma neovascolare sono possibili ma molto meno frequenti che in caso di occlusioni venose.
In circa il 10% dei pazienti, la presenza di un arteria suppletiva che è l’arteria cilioretinica assicura anche in presenza di Occlusione arteriosa della arteria centrale retinica un apporto di sangue sufficiente alla fovea (la parte di macula retinica più importante per la visione). In questo ultimo caso l’acuità visiva si mantiene davvero relativamente buona e in alcuni pazienti più fortunati, oltre alla visione centrale (che consente di leggere e scrivere), può essere conservata anche la periferia del campo visivo. Occlusione di branca dell’arteria centrale della retina è un quadro ad insorgenza acuta con caratteristiche variabili in rapporto all’estensione ed alla localizzazione dell’area retinica nutrita dal vaso occluso.
Le cause di un’occlusione arteriosa di branca sono le stesse dell’Occlusione dell’arteria centrale retinica. Il paziente avverte una limitazione solo parziale del campo visivo che è in genere a limiti netti. L’acuità visiva è variabile: risulta fortemente compromessa quando la branca arteriosa occlusa nutre la regione maculare, ben conservata se l’ischemia retinica non interessa quest’area.
La prognosi di un’occlusione arteriosa di branca è solitamente migliore di quella dell’Occlusione dell’Arteria centrale retinica l’amputazione del campo visivo normalmente si stabilizza dopo una sua parziale regressione ed il recupero dell’acuità visiva dipenderà dall’interessamento o meno dell’area foveale.
Nel caso di occlusione arteriosa retinica di branca il rischio d’ insorgenza di glaucoma neovascolare è praticamente nullo.
Occlucione venosa retinica
La definizione di occlusione venosa retinica (Retinal Vein Occlusion, RVO) accomuna un gruppo eterogeneo di malattie vascolari retiniche in grado di determinare un severo deterioramento della funzione visiva e che si differenziano per patogenesi, aspetti clinici, decorso e complicanze.
Le occlusioni venose retiniche si verificano quando è ostruita la circolazione di una vena retinica: il blocco della circolazione determina la formazione di emorragie retiniche e possono essere conseguenze comuni lo sviluppo di aree ischemiche (aree scarsamente irrorate) e/o di edema maculare. L’occlusione può interessare la vena centrale della retina, e si tratta quindi di Occlusione della Vena Centrale della Retina (CRVO), oppure solo un ramo di essa e, in tal caso, si tratta di Occlusione Venosa di Branca Retinica (BRVO).
Il sito preferenziale per l’occlusione della vena centrale della retina è la lamina cribrosa e l’occlusione si verifica a causa della turbolenza di flusso e della presenza concomitante di altri fattori reologici o alterazioni parietali.
Il sito preferenziale per l’occlusione di branca è invece l’incrocio artero-venoso e sembrerebbe che tale occlusione sia causata da un processo multifattoriale che include ostruzione meccanica e maggiore viscosità ematica.
Nonostante siano disponibili in letteratura numerose pubblicazioni sull’argomento, la classificazione, la patogenesi e la gestione di tale patologia restano controverse.
Nei soggetti più giovani è stata riscontrata, in alcune casistiche, un’associazione fra RVO e mortalità complessiva o mortalità cardiovascolare o ictus.
Fattori di rischio
I fattori di rischio che predispongono a RVO sono molteplici e in genere sono gli stessi che si riscontrano in alterazioni vascolari che coinvolgono altri distretti corporei come nel caso di ictus o coronaropatie. Sia per l’occlusione della vena centrale che per quella di branca i principali fattori predisponenti sono sicuramente i fattori di rischio cardiovascolare come arteriosclerosi, ipertensione arteriosa, diabete mellito, iperlipidemia, obesità, fumo, occlusione della carotide.
I fattori di rischio cardiovascolare sono particolarmente importanti in quanto il sito dell’occlusione della vena centrale della retina è la lamina cribrosa. L’arteria e la vena a livello della lamina cribrosa, prima di entrare nel globo, decorrono parallele, strettamente unite. Pertanto, alterazioni parietali dell’arteria centrale della retina, indotte da aterosclerosi e ipertensione, si riflettono sulla parete della vena centrale, soprattutto quando essa passa nel restringimento rappresentato dalla lamina cribrosa, incompressibile e che con l’avanzare dell’età si può caricare di sali di calcio (teoria di senescenza del collageno). Questo rappresenta il primum movens della turbolenza di flusso che causa l’occlusione della vena centrale della retina.
Altri importanti fattori di rischio sono le alterazioni reologiche (ematocrito aumentato, aumentata viscosità del plasma, aumentata aggregazione dei globuli rossi, ridotta deformabilità dei globuli rossi). Infatti, i capillari della periferia retinica presentano un calibro inferiore rispetto alle dimensioni degli eritrociti e solo eritrociti molto elastici, in grado di deformarsi, riescono ad attraversarli.
Inoltre, sono estremamente importanti alterazioni della viscosità del plasma: nelle sindromi da iperviscosità si possono presentare quadri bilaterali di occlusione centrale della vena della reti Altri importanti fattori di rischio riguardano lo stato trombofilico: iperomocisteinemia, anticorpi anti-fosfolipidi, resistenza alla proteina C attivata (fattore V di Leiden), mutazioni, ridotti livelli di inibitori del plasminogeno, contraccettivi orali.
Esistono inoltre importanti fattori di rischio locali: glaucoma (rischio di CRVO 5-7 volte superiore rispetto al soggetto sano); trauma (generalmente presente nell’anamnesi dei pazienti con CRVO); vasculite retinica; occlusione dell’arteria centrale; tutte le condizioni che provocano una riduzione del canale della lamina cribrosa come drusen, papilledema; malformazioni artero-venose che sono causa di ipertensione venosa; sindrome di iperviscosità (policitemia, macroglobulinemia, mieloma, leucemia).
Classificazione clinica
Il sito preferenziale per l’occlusione della vena centrale della retina è la lamina cribrosa. Arterie e vene decorrono parallele e le alterazioni parietali dell’arteria si riflettono sulla parete venosa che ovviamente si lascia facilmente comprimere al passaggio all’interno della lamina cribrosa: man mano che si instaura il restringimento del lume, il flusso di sangue attraverso la vena centrale della retina diventa sempre più turbolento e a sua volta provoca una riduzione della velocità di circolo. Pertanto, in presenza di altri fattori reologici o di alterazioni parietali si creano tutti i presupposti della triade del Virchow che determina l’occlusione.
L’aumento della stasi provoca un aumento della pressione endovasale che causa l’edema e spiega dunque l’emorragia; contemporaneamente si ha una riduzione del flusso che provoca ischemia, aumento del VEGF e danno endoteliale. Il quadro si completa con aumento dell’edema e accentuazione dell’ischemia fino al quadro del glaucoma neovascolare.
Il sito preferenziale per l’occlusione di branca è l’incrocio artero-venoso. La causa di BRVO è probabilmente un processo multifattoriale che include ostruzione meccanica (dovuta ad alterazioni degenerative nelle arteriole), componenti emoreologiche anomale e impedenze del flusso sanguigno, che provocano una maggiore viscosità. Gli studi dimostrano che nel 30% dei casi fisiologicamente la vena passa sopra l’arteria; tuttavia le statistiche percentuali di occlusione di branca confermano che il passaggio della vena sopra l’arteria si osserva solo nel 2.4% dei casi, mentre è preponderante la situazione opposta e cioè il passaggio dell’arteria sopra la vena.
Diagnosi
Ancora oggi la diagnosi di occlusione venosa retinica viene posta principalmente mediante valutazione oftalmoscopica; si rivelano tuttavia estremamente utili i test morfologici e funzionali.
I test funzionali si sono dimostrati superiori a quelli morfologici nel differenziare le forme ischemiche e le non ischemiche
La Fluorangiografia deve essere utilizzata solo per differenziare le forme ischemiche dalle non ischemiche e quindi per indirizzare l’eventuale più corretta terapia.
Per la diagnosi si eseguono l’oftalmoscopia, l’esame biomicroscopico del fondo oculare, la fluoroangiografia e l’OCT (utile soprattutto nel follow-up del paziente).
Terapia medica
In letteratura non esistono molte evidenze sull’approccio farmacologico sistemico. Tipicamente la plasmaferesi si utilizza nelle forme autoimmuni; pertanto, se si ritiene che alla base della patologia non vi sia una malattia di questo tipo è preferibile utilizzare un’emodiluizione.
Il principio base dell’emodiluizione nelle occlusioni venose retiniche si fonda sull’abbassamento dell’ematocrito per ottenere una riduzione della viscosità ematica al fine di migliorare la microcircolazione e la perfusione capillare retinica. Diverse ricerche hanno riferito risultati clinici e funzionali positivi grazie all’emodiluizione. In particolare, è stato descritto un incremento dell’acuità visiva insieme ad un miglioramento sia dei parametri emodinamici (tempo arterovenoso, velocità arteriosa media) che emoreologici (viscosità del plasma, ematocrito, fibrinogeno, aggregazione eritrocitaria). Diverse condizioni mediche possono essere associate all’occlusione della vena centrale della retina; è interessante notare che alcune (come ad esempio ipertensione, diabete mellito, iperlipidemia, iperviscosità, anormalità piastriniche) sono tipicamente associate ad aumentato rischio trombotico arterioso, mentre altre (come ad esempio gravidanza, preeclampsia, leucemia) si associano essenzialmente ad un aumentato rischio trombotico venoso; altre condizioni mediche (come ad esempio uso di contraccettivi orali, criofibrinogenemia, lupus eritematoso sistemico, vasculite sistemica, malattia renale) possono essere associate sia a manifestazioni trombotiche arteriose che venose, e quindi ad aumentato rischio trombotico sistemico(17). Esistono condizioni mediche essenzialmente associate ad aumentato rischio trombotico venoso, altre tipicamente associate ad aumentato rischio trombotico arterioso, altre ancora possono essere associate ad aumentato rischio trombotico sia arterioso che venoso.
In soggetti giovani affetti da RVO, con età compresa tra 43 e 69 anni, l’aumentato rischio di mortalità cardiovascolare impone una profilassi primaria degli eventi cardiovascolari mediante trattamento a lungo termine con farmaci antitrombotici.
L’ipercoagulabilità, la trombofilia e l’iperomocisteinemia moderata hanno un ruolo importante nei pazienti affetti da RVO.
I farmaci antitrombotici, almeno in alcune categorie di pazienti, possono essere utilizzati nel trattamento della fase acuta della RVO o in associazione con farmaci intravitreali.
Terapia laser
Il laser non è una strategia terapeutica atta a curare l’RVO, ma esclusivamente per il trattamento delle sue complicanze (edema maculare o neovascolarizzazione). Il trattamento laser ha rappresentato lo standard of care per edema maculare secondario ad occlusioni venose di branca; in caso di CRVO ischemiche o neovascolarizzazione retinica secondaria a OBVCR il trattamento laser periferico è utile per controllare la neoangiogenesi.
Il laser può determinare un limitato miglioramento dell’acuità visiva o nessun miglioramento, a seconda delle sottocategorie di pazienti.
In ogni caso, a causa dei suoi limiti (possibili danni visivi a livello centrale), risultano indispensabili nuovi approcci terapeutici.
Terapie intravitreali
L’uso dei farmaci anti-VEGF nei disordini retinici vascolari induce un miglioramento dell’acuità visiva ed una riduzione dello spessore maculare, a breve termine, necessita di un numero di iniezioni multiple per la gestione della patologia (reiterazione della procedura).
Sempre a breve, è stato dimostrato un indubbio profilo di sicurezza sia oculare che sistemico. Il trattamento anti-VEGF potrebbe rivelarsi utile nella gestione delle complicanze dell’RVO come il glaucoma neovascolare.
A seconda della tipologia di pazienti, possono verificarsi diverse risposte terapeutiche: è necessario approfondire ulteriormente i fattori predittivi (p.es. durata RVO). Sono utili studi clinici randomizzati controllati per rispondere ad alcune questioni ancora aperte (schema terapeutico, timing dell’intervento…).
Tra gli steroidi, un impianto intravitreale iniettabile contenente desametasone ha dimostrato dopo somministrazione semestrale nei pazienti con occlusioni venose retiniche un miglioramento dell’acuità visiva maggiore e più rapido rispetto al controllo, una riduzione dello spessore maculare, così come un ottimo profilo di sicurezza, rappresentando il primo farmaco on label per il trattamento dell’edema maculare secondario ad occlusioni venose retiniche centrali e di branca.
Tumori della retina
Cosa sono li tumori della retina?
I principali tumori intraoculari sono il retinoblastoma nel bambino, e nell’adulto il melanoma coroideale, le metastasi coroideali il carcinoma e melanoma della congiuntiva.
I tumori orbitari più frequenti sono: l’angioma (benigno del bambino e dell’adulto), il rabdomiosarcoma (maligno del bambino), il linfoma e le metastasi (maligni, dell’adulto).
Melanoma coroideale
Il melanoma della coroide rappresenta il tumore maligno primitivo intraoculare più frequente nell’adulto. La diagnosi avviene prevalentemente con l’oftalmoscopio (oftalmoscopia binoculare indiretta) insieme con l’esame clinico e l’ecografia oculare (tecnica A-B scan) che consente di valutare lo spessore del tumore la dimensione e la sua struttura interna. Il suo aspetto oftalmoscopico è quello di una lesione iperpigmentata sottoretinica, associata spesso a distacco di retina satellite. La radioterapia conservativa (brachiterapia o protoni accelerati) è oggi in grado di trattare in modo soddisfacente molti d casi. Per lesioni troppo grandi si ricorre ancora all’enucleazione del bulbo oculare. Nonostante i favorevoli risultati nel trattamento locale della neoplasia, il melanoma della coroide rimane tuttora una patologia potenzialmente mortale, con un rischio di metastatizazione a 5 anni di circa il 50 per cento.

Metastasi coroideali
Le metastasi coroideali sono considerate la neoplasia intraoculare maligna più frequente, anche se il loro riscontro clinico è piuttosto raro perché colpiscono generalmente pazienti in fase avanzata di malattia sistemica, in cui la visita oculistica è spesso omessa. La diagnosi è principalmente oftalmoscopica, anche se va supportata da uno studio ecografico e, eventualmente, angiografico.
L’aspetto oftalmoscopico è quello di lesioni singole, ma più spesso multiple e/o bilatrali, ipopigmentate, sottoretiniche, localizzate principalmente al polo posteriore, vicino a nervo ottico e macula. Il trattamento delle metastasi coroideali è un trattamento multidisciplinare, basato su chemioterapia sistemica e, eventualmente, radioterapia (standard o brachiterapia) o altri trattamenti focali (terapia fotodinamica).
Retinoblastoma
Il retinoblastoma è il tumore intraoculare maligno più frequente nell’età pediatrica. A seconda dei casi può interessare uno o entrambi gli occhi e può essere ereditario o meno. Ad oggi il retinoblastoma è un tumore che ha una percentuale di sopravvivenza molto alta (>95 per cento).
La diagnosi è principalmente oftalmoscopica, anche se va supportata da uno studio ecografico e da una RM orbitaria e encefalica. L’aspetto oftalmoscopico è di una massa retinica bianca, singola o multipla, mono o bilaterale, spesso associata a disseminazione nell’umor vitreo di cellule neoplastiche (seeding vitreale). Il segno più comune d’esordio è la leucocoria (riflesso bianco pupillare), che però spesso rimane purtroppo un segno tardivo.
La terapia standard del retinoblastoma è la chemioriduzione (chemioterapia sistemica mirata a far diminuire di dimensioni le lesioni oculari) associata a terapie focali di consolidamento (termoterapia, crioterapia, brachiterapia). La radioterapia ab externo è stata oggi in parte abbandonata per il provato rischio di insorgenza di seconde neoplasie in bimbi con mutazione genetica del gene RB (responsabile del retinoblastoma). L’enucleazione del bulbo oculare rimane una terapia curativa in casi con neoplasia localmente avanzata.
Emangioma coroideale circoscritto
L’emangioma coroideale è il più frequente tumore primitivo vascolare della coroide. Il tumore rimane generalmente misconosciuto fino a quando diventa sintomatico. La comparsa di sintomi, calo dell’acuità visiva e o metamorfopsie, avviene generalmente nella terza o quarta decade di vita. Oftalmoscopicamente il tumore appare come una massa sottoretinica di un colore rosso arancio spesso identico a quello della coroide circostante. Sulla superficie tumorale possiamo ritrovare foci bianco-giallastri o più frequentemente accumuli di pigmento sottoretinico a livello di epitelio pigmentato retinico.
L’emangioma della coroide è un tumore benigno e quindi il trattamento non è finalizzato alla distruzione del tumore ma al mantenimento della migliore acuità visiva per il maggior tempo possibile. Se il paziente non ha sintomi o calo dell’acuità visiva il trattamento non è necessario ed il paziente andrà controllato nel tempo. Se un sollevamento del neuroepitelio determina un calo dell’acuità visiva il trattamento dovrà essere preso in considerazione. Il trattamento oggi più utilizzato è la terapia fotodinamica.
Valutazione clinica
L’approccio ad un soggetto presumibilmente affetto da una malattia tumorale (neoplastica) dell’occhio o del contenuto orbitario necessita di una meticolosa ed attenta valutazione oftalmologica preliminare capace di evidenziare anche dalla storia clinica personale o familiare elementi utili alla diagnosi e prognosi del singolo caso. Sarà quindi analizzata la storia familiare per malattie neoplastiche o eredo-degenerative e dovranno essere esaminati.
In casi specifici vengono valutati anche familiari del soggetto in esame.
Si esegue una completa valutazione oftalmologica completa (acuità visiva, esame biomicroscopico del segmento anteriore e posteriore, oftalmoscopia, pressione endoculare) ed il paziente viene sottoposto a tutte le indagini ritenute utili al caso specifico (esame del campo visivo, esoftalmometria, studio della funzionalità retinica e della via ottica).
Le lesioni riscontrate dovranno sempre essere documentate fotograficamente: questa indagine è fondamentale per valutare obiettivamente nel tempo la storia naturale o l’effetto della eventuale terapia sulle lesioni riscontrate.
Esami strumentali
Ecografia bulbare
Questa metodica semeiologica si avvale degli ultrasuoni per esaminare le lesioni dell’iride, della coroide e retina, e dell’orbita. Le metodiche utilizzate sono sia monomodale (A scan utile per un’analisi tissutale) che bimodale (B scan), quest’ultima indispensabile soprattutto a fini topografici (dimensioni e rapporti della lesione con le strutture circostanti. La cosiddetta biomicroscopia ad ultrasuoni (UBM) non è altro che una metodica di analisi ultrasonografica che impiega sonde capaci di alta definizione in particolare delle strutture del segmento anteriore dell’occhio (camera anteriore, angolo camerulare e corpo ciliare).
Angiografia retinica e coroideale
L’impiego della angiografia retinica e coroideale (sia con fluoresceina che con verde di indocianina) consente uno studio completo ed accurato della circolazione normale e patologica di questi due distretti. Lo studio angiografico ha alcune indicazioni specifiche in oncologia oculare: la visualizzazione dei circoli patologici delle lesioni neoplastiche; la valutazione degli effetti della massa neoplastica sulle strutture retiniche e coroideali normali; il controllo – con esami ripetuti nel tempo secondo scadenze prefissate – dell’efficacia dei trattamenti ed in particolare dei danni indotti dalla terapia sui tessuti normali (follow-up clinico). Lo studio angiografico non ha controindicazioni specifiche nei pazienti con neoplasie intraoculari.
Indagini neuroradiologiche
Lo studio neuroradiologico rappresenta l’evoluzione della diagnostica radiologica tradizionale nella valutazione dei tumori dell’occhio e dell’orbita. Tomografia assiale computerizzata (TC, con e senza contrasto, con tecnica tradizionale o spirale) e risonanza magnetica nucleare (RM, con e senza contrasto, con e senza tecnica di sottrazione del grasso) sono le più importanti tecniche neuroradiologiche. Esse trovano indicazioni specifiche (limitate) nei tumori intraoculari, risultando complementari all’esame ecografico (valutazione di calcificazioni intraoculari, studio della estensione extrasclerale delle lesioni e del nervo ottico, rilievo di diffusione della malattia intraoculare a livello cerebrale, analisi delle caratteristiche magnetiche del tumore). TC e RM sono invece indispensabili nello studio topografico dei tumori dell’orbita a scopo diagnostico, di centraggio bioptico e di valutazione del piano terapeutico e del decorso clinico.
Esame istologico
Quando le metodiche precedentemente illustrate non sono in grado di condurre ad una diagnosi clinica precisa ed il dubbio diagnostico risulti dirimenti nella scelta terapeutica, è indispensabile ricorrere – data la delicatezza e particolare sede delle lesioni neoplastiche oculari e orbitaria – ad uno studio morfologico (citologico) delle stesse. La citologia per scraping o impronta è la tecnica di esame delle malattie neoplastiche coinvolgenti la congiuntiva, la cornea e le palpebre. Per i tumori intraoculari o orbitari è necessario ricorrere alla citologia per aspirazione con ago sottile (Fine needle aspiration biopsy: FNAB). Questa richiede particolare esperienza (come avviene nel nostro Centro) e viene condotta direttamente sulla lesione utilizzando tecniche di centramento diretto (oftalmoscopio o microscopio operatorio per i tumori intraoculari, TC per i tumori orbitari). Il materiale prelevato può anche essere sottoposto alle più moderne tecniche di analisi biologica (citometria a flusso, genetica molecolare, citogenetica).
Tomografia a Coerenza Ottica
La Tomografia a Coerenza Ottica (OCT è la sigla inglese) esamina dal punto di vista strutturale la retina e parte dei tessuti ad essa adiacenti (epitelio pigmentato retinico, coriocapillare, interfaccia vitreo-retinica) in modo rapido e non invasivo. Recentemente sono stati introdotti moduli d’indagine anche per il segmento anteriore, in particolare cornea, iride e angolo irido-corneale e cogiuntiva. Come l’ecografia, essa fornisce un’analisi in sezione dei tessuti esaminati Il suo utilizzo nell’ambito dell’oncologia oculare riguarda principalmente la diagnostica delle alterazioni corioretiniche secondarie alle lesioni neoplastiche e il follow-up post trattamento.
L’autofluorescenza
L’autofluorescenza è un’altra recente metodica di imaging del fondo oculare che si sta dimostrando molto utile nella valutazione clinica delle patologie corioretiniche. Anche in questo caso si tratta di un esame semplice, rapido e non invasivo. Molte delle sostanze coinvolte negli aspetti organizzativi e metabolico-funzionali di retina ed epitelio pigmentato retinico si comportano da fluorofori endogeni, ovvero sono in grado di emettere un segnale di fluorescenza quando eccitati ad opportune lunghezza d’onda. Le caratteristiche del segnale di fluorescenza dipendono dalla natura e dalla concentrazione di tali fluorofori e dalla loro distribuzione all’interno del substrato biologico. Su queste basi, modificazioni delle condizioni del substrato biologico conseguenti all’insorgenza di situazioni patologiche si ripercuotono sulle proprietà di autofluorescenza dello stesso, determinandone alterazioni che possono essere sfruttate a fini diagnostici. Consentendo di localizzare su un’immagine topografica della retina aree di modificazione della normale autofluorescenza dei pigmenti retinici, questa tecnica offre informazioni complementari a quelle dell’OCT.
Qualora le metodologie anzidette, soprattutto per lesioni orbitarie, non siano dirimenti si ricorrerà alla biopsia chirurgica incisionale o escissionale (asportazione parziale o totale della lesione). La valutazione completa dei singolo caso potrà richiede il ricorso ad approfondimenti diagnostici specifici; qui ricordiamo: stadiazione pre operatoria e nel follow-up dei melanomi coroideali,ecografia epatica, PET-CT e studio della funzionalità del fegato; TC total-body e biopsia ossea e midollare nei pazienti con linfoma orbitario, markers tumorali di malattia in presenza di metastasi oculari o orbitarie.
Terapia
La terapia in oncologia oculare-orbitaria si basa su una pianificazione di equipe (team oncologico) e spetta all’oncologo oculare il coordinamento di questa attività. L’indicazione della terapia specifica per il singolo caso è costituita dalla somma dei dati ottenuti dalle singole valutazioni diagnostiche più sopra elencate. Attualmente l’approccio ai tumori oculari è per quanto possibile conservativo, mirando ad asportare radicalmente la lesione neoplastica preservando l’occhio e la funzione visiva. Quando la conservazione del bulbo oculare affetto dalla neoplasia (maligna) può costituire pericolo per la vita del paziente, l’occhio dovrà essere enucleato. I tumori congiuntivali, palpebrali e del contenuto orbitario vengono trattati conservativamente: in questi casi deve essere limitato, per quanto possibile, il danno al bulbo oculare.
Alla chirurgia può essere associata la Radioterapia
Questa costituisce la principale, e più efficace metodica di trattamento dei tumori maligni e benigni dell’occhio. Melanoma e metastasi della coroide sono indicazioni elettive alla radioterapia. La radioterapia è principalmente applicata per contatto (placchette episclerali caricate con isotopi radiottivi), o con sorgenti esterne (acceleratore lineare o di particelle pesanti).
Anche il retinoblastoma è estremamente sensibile alla radioterapia, ma queste trova oggi un impiego più limitato nel tentativo di evitare le complicanze sulle strutture extraoculari in questi bambini, che sono geneticamente suscettibili ad altre neoplasie. Numerose neoplasie orbitarie sono trattate elettivamente ed esclusivamente con radioterapia, come i linfomi orbitari (la più frequente neoplasie orbitaria primitiva dell’adulto) o le metastasi.
Termoterapie transpupillari
E’ una tecnica di trattamento di recente introduzione (che sfrutta il principio dell’ipertremia con laser ad infrarosso), il cui impiego è limitato ai centri ad alta specializzazione che dispongano anche della radioterapia. Trova indicazione, associata alla chemioterapia, nella cura del retinoblastoma, e isolatamente (o associata alla radioterapia con placche espisclerali) in quella di piccoli melanomi della coroide selezionati.
Terapia chirurgica
La chirurgia trova indicazione nell’oncologia oculare ed orbitaria secondo queste sintetiche indicazioni: – escissione completa di tumori congiuntivali (con ricostruzione) – escissione completa di tumori palpebrali con eventuale plastica ricostruttiva – escissione con metodica conservativa dei tumori intraoculari del corpo ciliare e della coroide che abbiano dimensioni limitate e ben definite (deve essere associata alla radioterapia con placche, per evitare le recidive) – enucleazione del bulbo oculare non salvabile (in caso di melanoma della coroide o retinoblastoma, o altri più rari tumori intraoculari) – escissione di tumori orbitari (approccio combinato multidisciplinare con selezione dei singoli casi), fino alla rimozione dell’intero contenuto della cavità orbitaria (exenteratio orbitae).
Chemioterapia
La chemioterapia sistemica è inserita nel piano terapeutico dei tumori dell’occhio e dell’orbita secondo un approccio multidisciplinare; le indicazioni principali sono: retinoblastoma (associata a terapie locali conservative, e dopo enucleazione come terapia adiuvante in casi specifici; nelle metastasi); metastasi del melanoma della coroide o della congiuntiva; metastasi coroideali multiple (di diversa origine); linfoma orbitario a diffusione sistemica; metastasi orbitarie e tumori orbitari dopo rimozione chirurgica (associata o meno a radioterapia). La chemioterapia topica si avvale dell’uso di sostanze antiblastiche in forma di colliri o pomate. Le preparazioni in collirio non sono commercialmente disponibili e vengono predisposte nei centri ad alta specializzazione (come il nostro) che seguono direttamente il paziente. Sono impiegate principalmente nella cura dei tumori della congiuntiva, soprattutto quelli multicentrici e diffusi.
Terapia fotodinamica
La terapia Fotodinamica (PDT) è una forma di trattamento non chirurgico. Nella PDT viene utilizzato un agente fototerapeutico (Verteporfina), la cui azione viene ottenuta in due fasi differenti. Nella prima fase la verteporfina viene somministrata per via endovenosa, ed essa va ad accumularsi nei vasi anomali dell’area corio-retiniche da trattare. Nella seconda fase viene applicato un trattamento laser a bassa potenza (incapace, da solo, di creare danni retinici nell’area trattata) ottenendo l’attivazione della sostanza iniettata. L’attivazione della sostanza determina una foto trombosi selettiva dei vasi patologici. Questo trattamento, inizialmente introdotto in oftalmologia per la cura della degenerazione maculare legata all’età, è oggi ampiamente utilizzato nel trattamento degli emangiomi coroideali circoscritti e in metastasi coroideali in casi selezionati.
Trattamenti combinati
Si intende, come già segnalato, l’impiego delle diverse metodiche anzidette per la terapia di casi singoli. In oncologia oculare ed orbitaria le indicazioni principali sono: retinoblastoma, linfoma congiuntivale o orbitario e metastasi. Il piano terapeutico è sempre stabilito con valutazione multidisciplinare.
Maculopatie
Cosa sono le Maculopatie?
La macula è la porzione più preziosa della retina, al centro della macula vi è la fovea, depressione retinica dove si trova la foveola, la zona più sottile retinica in cui sono presenti solo i coni, fotorecettori in grado di trasformare i segnali luminosi in impulsi elettrochimici, responsabili anche della percezione dei colori (a differenza dei bastoncelli, abbondanti nella periferia retinica, che vengono sfruttati solo per percepire forme e movimento in condizioni di scarsa luminosità).
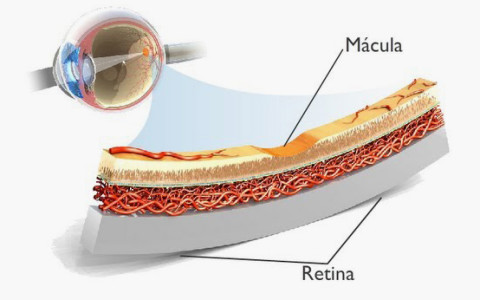
Maculopatie
La degenerazione maculare o maculopatia colpisce quindi la porzione più preziosa della retina deputata alla visione distinta
Se è ad andamento progressivo e può portare alla perdita completa ed irreversibile della visione centrale.
I sintomi principali della maculopatia sono: riduzione della acuità visiva centrale con permanenza di quella periferica, distorsione delle immagini per cui, ad esempio, una riga non appare più dritta, alterazione della percezione dei colori che appaiono sbiaditi, presenza di un’area del campo visivo vicino o comprendente il punto di fissazione in cui la visione non è distinta. Possiamo paragonare il nostro occhio ad una macchina fotografica, e riconoscere alcune parti come la cornea e il cristallino come se fossero l’obiettivo, deputato ad una corretta messa a fuoco; la retina sarebbe la pellicola della macchina fotografica. Il deterioramento di questa area retinica causa una riduzione della acuità visiva anche molto marcata ma, essendo risparmiata la retina periferica, non si arriva alla cecità assoluta. Infatti, la retina periferica, non colpita dalla malattia, permette di conservare la visione laterale.
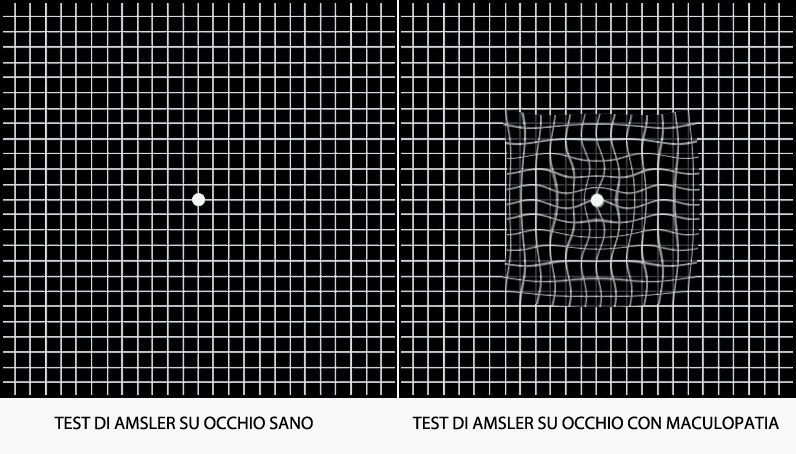
Risulteranno quindi difficoltosi o impossibili la lettura e il lavoro a distanza ravvicinata ma, anche se sono interessati entrambi gli occhi, si rimane comunque autosufficienti. Non sono ancora noti i motivi che comportano il deterioramento e la degenerazione del tessuto maculare, anche se sembra sia legata a fattori ereditari oltre che all’età. L’evoluzione è molto lenta nelle forme secche (maculopatia senile), più rapida nelle forme umide (essudative). Un esame molto semplice per individuare la patologia in uno stato precoce è il test di Amsler.
Guardando un foglio di carta quadrettato con opportuna correzione ottica, se fissando il punto situato al centro del foglio si osserva una distorsione (metamorfopsia) o una interruzione delle righe vuol dire che esiste un problema alla retina centrale.
Maculopatia miopica
La maculopatia miopica si presenta nella miopia degenerativa o patologica, malattia caratterizzata da un aumento della lunghezza assiale dell’occhio (> 26mm) e da una miopia superiore alle 6 diottrie. In questa forma di miopia si determinano una serie di alterazioni che riguardano prevalentemente il segmento posteriore dell’occhio dove si verifica una distensione della sclera ed un assottigliamento della coroide e della retina. La causa delle alterazioni dell’occhio miope non sono ancore ben chiarite e comunque non sono prevenibili, così come non si può arrestare una eventuale progressione della miopia.
Spesso nella miopia patologica si hanno delle emorragie maculari con improvvisa diminuzione dell’acutezza visiva, talvolta con metamorfopsie.
L’emorragia è rotonda, densa, profonda (sottoretinica) spesso centrata sulla fovea.
Di estrema importanza è stabilire la causa della emorragia. Questa può essere provocata da una rottura della membrana di Bruch ed in tali casi l’emorragia si riassorbe spontaneamente talora senza alcuna variazione della vista. Altre volte l’emorragia è provocata da una neovascolarizzazione sottoretinica che deve invece essere individuata per poter procedere ad un successivo trattamento laser.
Le degenerazioni maculari
La degenerazione maculare senile (DMS).
La degenerazione maculare senile (DMS) è la più comune causa di cecità legale nei pazienti che hanno più di 60 anni di età. La DMS ha una prevalenza che varia dal 8.5% al 11% nella fascia di età compresa tra i 65 e i 74 anni, e del 27% al di sopra dei 75 anni. La DMS è strettamente correlata all’età; con l’avanzare di questa aumenta il rischio di malattia. Non sembra invece esserci una prevalenza di sesso anche se dopo i 75 anni di età prevale il sesso femminile probabilmente dovuto ad una maggiore sopravvivenza delle donne in questa fascia di età.
La DMS può essere associata ad una ereditarietà dominante con penetranza ad espressività variabile. Sono stati individuati numerosi fattori di rischio e ciò suggerisce che la malattia abbia eziologia multifattoriale. Innanzitutto il fumo di sigaretta che aumenta di tre volte il rischio di DMS; alcuni studi indicano nell’ipertensione arteriosa un importante fattore di rischio.
L’esposizione prolungata ad una intensa luce solare, per la diminuzione della fascia di ozono, può aumentare il rischio di maculopatia e così pure una diminuzione del livello ematico di micronutrienti con funzione antiossidante. Sono state classificati due principali tipi di degenerazione maculare senile: degenerazione maculare senile secca o atrofica degenerazione maculare senile umida o essudativa o neovascolare
Degenerazione maculare senile atrofica
Le drusen o corpi colloidi sono formazioni degenerative di forma rotondeggiante, giallastre, presenti soprattutto al polo posteriore. Istologicamente si distinguono in drusen dure, piccole, a margini netti e drusen soffici a margini non ben definiti, che tendono a confluire ed a diventare più grandi Nel corso dell’indagine fluorangiografica le drusen hanno aspetti differenti: quelle dure diventano iperfluorescenti nei primi angiogrammi mentre quelle soffici sono ipofluorescenti.
Nelle fasi tardive, le drusen dure perdono la loro iperfluorescenza mentre le drusen soffici diventano iperfluorescenti in quanto si impregnano di colorante .
Le drusen possono rimanere invariate per anni, non dando quindi nessun segno clinico, oppure evolvere verso la forma atrofica o verso la forma essudativa.
L’atrofia a carta geografica o areolare si presenta come una o più chiazze di colorito chiaro che lasciano intravedere i grossi vasi coroideali.
Le lesioni tendono a ingrandirsi ed a confluire fino ad assumere una forma circolare, ovale o policiclica con margini regolari.
Fluorangiograficamente si presentano come aree iperfluorescenti (effetto finestra) alternate ad aree ipofluorescenti (effetto schermo) per l’accumulo di pigmento.
La vista è diminuita soprattutto nella forma evoluta, ma generalmente l’evoluzione è molto lenta.
Degenerazione maculare senile essudativa
Questa forma è caratterizzata da una neovascolarizzazione sottoretinica coroideale associata o meno ad un distacco sieroso dell’epitelio pigmentato. Queste lesioni tendono normalmente ad evolvere; compaiono essudati duri disposti a corona attorno alla lesione e spesso sono presenti delle emorragie. Questa neovascolarizzazione talora chiamata anche membrana neovascolare è costituita da piccoli vasi a provenienza dalla coroide (vasi che normalmente non dovrebbero essere presenti e che hanno una conformazione anomala). Con il passare del tempo la lesione tende ad estendersi, i margini diventano frastagliati, indistinti con la formazione di una cicatrice fibrosa e profonda distruzione dei tessuti retinici al polo posteriore. Nelle fasi iniziali la sintomatologia è rappresentata da metamorfopsie (visione distorta) e/o da scotomi positivi (comparsa di macchie scure fisse) che possono essere ben evidenziate con lo schermo di Amsler o test della griglia. L’acuità visiva può essere in un primo tempo ancora buona. In seguito il visus tende a diminuire progressivamente fino ad arrivare, nelle fasi cicatriziali a circa 1/100. E’ importante sorvegliare l’occhio controlaterale in quanto ogni anno il 15% degli occhi controlaterali viene colpiti dalla stessa patologia. In caso di disturbi visivi è opportuno consultare immediatamente il proprio oculista.
La fluorangiografia è l’esame diagnostico fondamentale nella degenerazione maculare senile. Questo esame deve essere effettuato rapidamente perché tanto prima si fa una corretta diagnosi tanto meglio si può intervenire con una terapia laser.
La fluorangiografia riesce però ad identificare i neovasi sottoretinici solo nel 15% circa dei casi.
Negli altri i neovasi sono chiamati “occulti” cioè non visibili perché mascherati dalle strutture retiniche, dalle emorragie e dagli essudati. La fluorangiografia al verde di indocianina sfruttando la sua emissione nell’infrarosso, permette di visualizzare la coroide, la struttura cioè dove nascono i neovasi.
Ciò ha consentito di evidenziare circa il 60-70% dei neovasi occulti, precisandone la localizzazione e pertanto migliorando la percentuale di occhi suscettibili di trattamento laser e la prognosi post-laser.
Un altro esame sempre più utilizzato nella diagnostica è l’OCT. Questo esame, meno invasivo serve a fotografare gli strati retinici e a quantificare il danno all’interno della retina stessa. E’ un esame che si esegue ambulatoriamente, senza alcuna iniezione, semplicemente fotografando il fondo dell’occhio dopo la dilatazione della pupilla.
Degenerazione maculari ereditarie
Costituiscono una causa significativa di diminuzione visiva nei ragazzi e nei giovani adulti. I sintomi, caratterizzati da una diminuzione progressiva o rapida dell’acuità visiva, si manifestano nell’infanzia o nell’adolescenza. A seconda delle modalità di trasmissione genetica si distinguono le degenerazioni maculari con carattere di trasmissione dominante, recessiva e legate al cromosoma X. Per alcune di queste sono già state individuate le alterazioni a livello genetico e speriamo pertanto che prossimamente la ricerca possa andare avanti in tal senso. Consigliamo comunque una valutazione genetica del problema.
Terapia medica
Prima di parlare di terapia bisogna valutare la possibilità di prevenzione. Si possono prescrivere lenti che proteggono dai raggi ultravioletti, e ovviamente vanno corretti gli eventuali fattori di rischio generali. Attualmente lo studio AREDS americano ha dimostrato l’efficacia dei farmaci antiossidanti nel rallentare l’insorgenza della malattia. Talora possono essere prescritte sostanze come le vitamine A,C,E, integratori minerali come lo zinco, il selenio, la luteina e la zeaxantina. Altri farmaci sono attualmente in fase di sperimentazione clinica, non tanto nella prevenzione quanto per le complicanze neovascolari non trattabili con il laser.
Terapia laser
La terapia che abbia comprovato la sua efficacia è la fotocoagulazione laser. Questa si propone di distruggere i vasi neoformati e pertanto di tentare di fermare l’evoluzione della malattia. Il laser può essere eseguito in presenza di neovasi non centrali, di dimensioni limitate e con visus discreto. I neovasi devono comunque essere ben visibili alla fluorangiografia da sola o con l’angiografia con indocianina. Quando la neovascolarizzazione è ampia si può effettuare un trattamento laser chiamato perifoveale che abbia lo scopo di salvare la parte centrale consentendo una certa capacità visiva. Il laser è comunque un trattamento ambulatoriale, indolore e può essere effettuato senza alcuna preparazione particolare. Purtroppo l’efficacia del laser è limitata. Infatti le recidive di questi neovasi sono molto elevate e spesso il trattamento laser deve essere ripetuto. In caso di recidiva centrale il laser non può essere più effettuato. Le recidive nei 2/3 dei casi compaiono entro i due-tre mesi dal trattamento e pertanto in questo periodo il paziente deve essere seguito molto spesso con più esami angiografici.
Terapia fotodinamica
La terapia fotodinamica ha dimostrato la sua efficacia in alcuni tipi di neovascolarizzazioni sottoretiniche, nello stabilizzare la lesione neovascolare anche a distanza di anni.
Terapia con iniezione intraoculare
In questo momento anche se la terapia fotodinamica può talora essere effettuata, le inezioni intraoculari rappresentano la terapia di scelta nel bloccare o migliorare il corso della malattia.
Negli ultimi anni si stanno sviluppando nuove terapie basate sul principio non tanto di distruggere la lesione vascolare causa di tutti i problemi, quanto di bloccare il cosiddetto VEGF, una proteina che provoca la formazione della lesione vascolare ed aumenta la permeabilità dei vasi con fuoriuscita di liquido dagli stessi. Gli studi degli ultimi anni ci stanno insegnando cos’è il VEGF e soprattutto hanno lo scopo di identificare con maggior precisione la struttura del VEGF ed i modi per attaccarlo. In realtà la soluzione non si è ancora trovata perché esistono diverse forme di VEGF e non è possibile distruggerle o bloccarle tutte. Al momento comunque vengono utilizzati alcuni farmaci (vedi capitolo delle nuove terapie) in grado di trattare con maggiori possibilità di successo la malattia, ed inoltre stiamo anche effettuando terapie multiple che sfruttano differenti farmaci e diverse modalità.
Modalità di somministrazione
L’iniezione viene praticata in regime di chirurgia ambulatoriale, con il paziente in posizione sdraiata con tutte le precauzioni adottate per un intervento chirurgico oculistico. Si utilizza una anestesia di tipo locale, cioè si instillano alcune gocce di collirio anestetico.
La procedura è usualmente indolore e prevede una iniezione del farmaco nel vitreo, la sostanza gelatinosa che riempie l’occhio. L’iniezione può essere ripetuta a seconda delle necessità ogni quattro-sei settimane e frequentemente viene ripetuta nel tempo.
Diagnosi
L’acuità visiva è il test più importante per valutare la funzionalità maculare. I pazienti, quando guardano attraverso un foro (detto stenopeico), vedono meno delle persone la cui vista è buona. L’esame del fundus oculi è ovviamente fondamentale perché consente di verificare lo stato della retina e l’eventuale progressione della malattia. La sola visita oculistica non sempre è sufficiente per una corretta diagnosi. Alcuni esami strumentali che l’oculista potrebbe prescrivere per confermare la diagnosi e classificare la malattia sono l’OCT, la fluorangiografia con fluresceina ed, eventualmente, anche con verde di indocianina. La terapia fotodinamica, le iniezioni intravitreali di triamcinolone o di farmaci anti-angiogenetici sono i trattamenti disponibili oggi, che possono essere somministrati come monoterapia oppure in combinazione per bloccare l’evoluzione di tali patologie I risultati sono tuttavia ancora modesti, è importante diagnosticarla in tempo per rallentarne sintomi e manifestazioni.
Patologie della retina
Cosa sono le patologie della retina?
La retina è una parte del nostro cervello che attraverso i nervi ottici porta gli stimoli luminosi alla corteccia cerebrale. In quanto tale è costituita da cellule nervose che sono dette “perenni”, quindi non in grado di riprodursi in caso di perdita o danno che sarà inevitabilmente grave e permanente.
Si può considerare come la pellicola di una macchina fotografica che impressionandosi alla luce, ne trasmette l’impulso al cervello. È composta da una parte centrale detta macula, che mette a fuoco nitidamente le immagini presiedendo alla visione distinta, e dalla restante porzione periferica.
La retina è costituita da 10 strati.
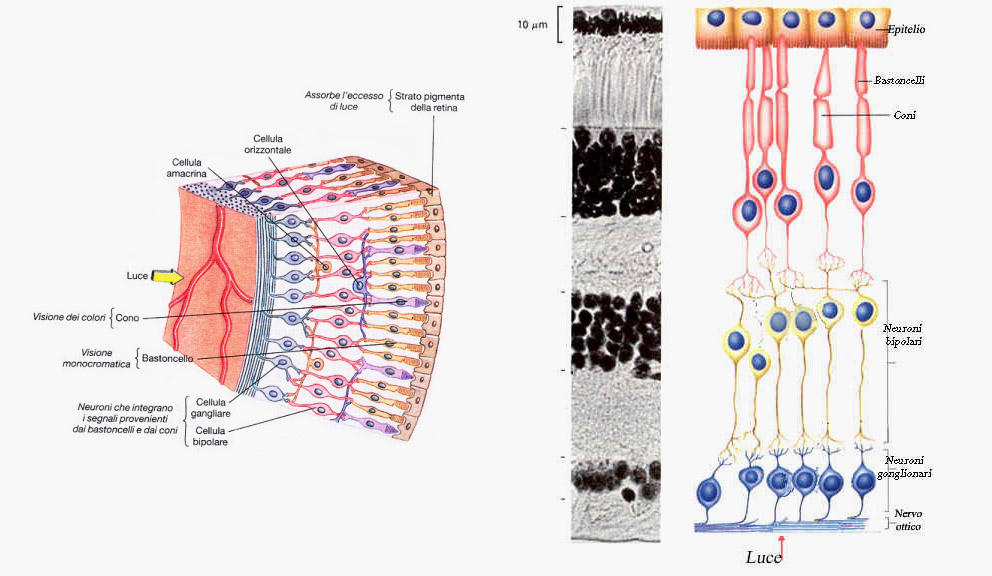
La macula è la porzione più preziosa della retina, al centro della…
Le patologie vascolari retiniche si distinguono in occlusione arteriosa retinica e occlusione venosa retinica…
Quando la retina si distacca dalla parete interna dell’occhio vi è una perdita delle capacità visive, rendendo l’occhio cieco in quel determinato settore…
I tumori della retina si distinguono in tumori intraoculari e tumori orbitari…
Molti pazienti con una vista molto bassa possono essere aiutati. Esistono oggi dei sistemi ottici ed…
Cataratta
Cos'è la cataratta?
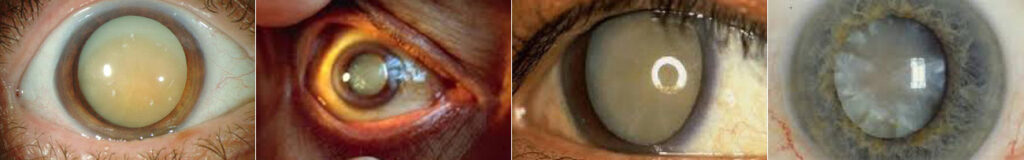
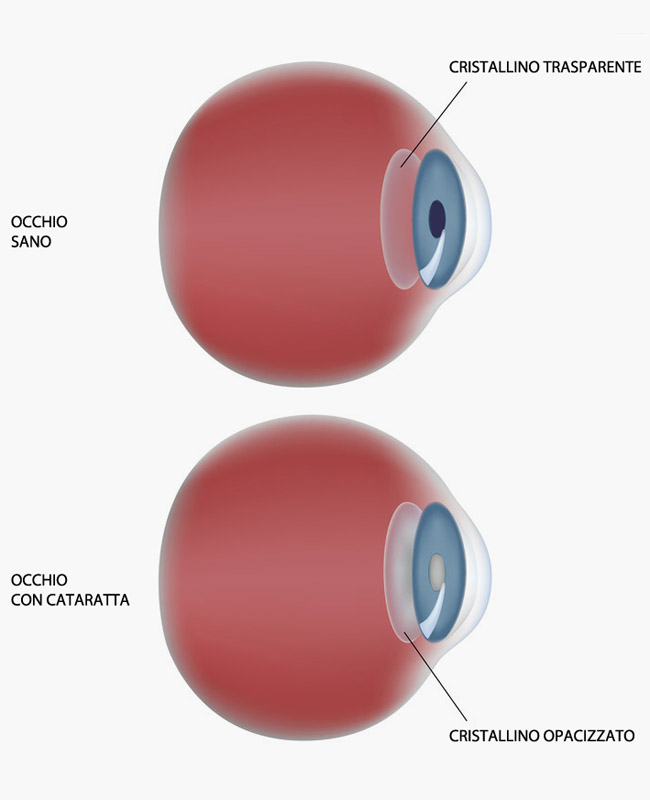
La cataratta consiste nell’opacizzazione progressiva del cristallino, lente naturale biconvessa situata all’interno del nostro occhio, appena dietro all’iride. L’opacizzazione è causata dall’aggregazione e dall’ossidazione delle proteine del cristallino, processo evolutivo caratteristico dell’invecchiamento.
La cataratta è la principale causa di cecità trattabile presente in tutti i paesi del mondo. Oltre i 65 anni circa la metà della popolazione sviluppa una cataratta e oltre i 75 anni la percentuale raggiunge il 90%.
Il sintomo principale della cataratta è l’annebbiamento progressivo, a volte con abbagliamento alla luce frontale, sdoppiamento delle immagini e talvolta un iniziale curioso “miglioramento” della vista.
Pertanto è consigliata una visita oculistica periodica oltre i 60 anni di età, anche in assenza di sintomatologia specifica.
Diagnosi
Per porre diagnosi di cataratta devono essere eseguiti:
Esame biomicroscopico completo con lampada a fessura in miosi ed in dilatazione.
Esame completo della refrazione e della acutezza visiva.
Terapia chirurgica
La cataratta si cura esclusivamente con l’intervento chirurgico. Il momento in cui intervenire è in rapporto al grado di evoluzione della cataratta e al disagio visivo che essa comporta nelle attività quotidiane più comuni, quindi è una decisione che coinvolge sia il medico che il paziente.
Gli esami strumentali necessari per l’intervento a seconda del tipo di cataratta e delle condizioni oculari del paziente sono:
- Ecobiometria
- Biomicroscopia dell’endotelio corneale
- Ecografia bulbare
- Eventuali esami retinici (fluorangiografia – tomografia OCT)
Topografia e tomografia corneale
Campimetria computerizzata e pachimetria corneale
Valutazione della motilità con visita ortottica.
L’intervento si esegue in anestesia topica (colliri). Non è una procedura dolorosa, viene eseguita in regime di day hospital, cioè senza ricovero notturno. L’intervento è di breve durata, si tratta di microchirurgia quindi si utilizza il microscopio operatorio, richiede una sufficiente collaborazione del paziente e consiste nell’asportazione del cristallino opaco e nell’impianto di una lente sostitutiva (cristallino artificiale o IOL).
Sebbene l’obiettivo sia quello di estrarre la cataratta per scongiurare una cecità sicura con il passare del tempo della stessa, l’evoluzione delle tecnologie applicabili a questo intervento sono molteplici come i nuovi i facoemulsificatori, i microscopi operatori che montano un sistema di centratura per l’impianto di IOL toriche, il laser a femtosecondi. A tale tecnologia si aggiunge anche quella che caratterizza i cristallini intraoculari. Si ricorre all’impianto di lenti intraoculari, disponibili in varie tipologie per adattarsi alle specifiche caratteristiche ed esigenze di ogni paziente.
La chirurgia facorefrattiva intraoculare viene quindi applicata anche in condizioni di patologia come la cataratta e può correggere ipermetropie o miopia molto elevate (tra 12 e 30 diottrie), astigmatismi e difetti multifocali (presbiopia) in casi selezionati.
Tale tecnica chirurgica, prevede delle microincisioni che permettano l’ingresso intraoculare di strumenti microscopici al fine di procedere alla sostituzione del cristallino. Solo alcune fasi di tale procedure possono essere eseguite grazie al support del laser al femtosecondi. Si tratta di un’anestesia topica (solo colliri anestetici), l’intervento dura pochi minuti ed il recupero visivo si ha rapidamente fin da poche ore dopo l’intervento.
Sono necessarie misure cautelative di igiene e comportamentali nei primi giorni, terapie in collirio e controlli scadenzati che vengono prescritte dal chirurgo.
Le lenti intraoculari (cristallini artificiali o IOL) che possono essere impiantate sono molteplici:
- Multifocali, ossia capaci di mettere a fuoco a due distanze, una da lontano e una da vicino
- Toriche, che consentono di correggere l’astigmatismo, difetto visivo congenito per cui gli oggetti appaiono distorti e sfuocati, sia da lontano sia da vicino
- Asferiche, la cui forma più curva nel centro e piatta ai bordi, compensando i naturali difetti della cornea, permette una visione migliore in qualsiasi situazione migliorando la sensibilità al contrasto
- Filtrate, che grazie a speciali pigmenti assorbono e filtrano i raggi dannosi per la retina, tra cui quelli solari ultravioletti.
Cheratocono
Cos'è il Cheratocono?
La cornea è una delle lenti più potenti dell’apparato visivo; trasparente, convessa, permette la convergenza delle immagini sul piano retinico. Ha uno spessore “normale” centrale medio di 520-540 µicron e ha una forma ellittica con il diametro maggiore orizzontale lungo 11,7 mm contro i 10,6 mm del diametro minore verticale. Il cheratocono e la degenerazione marginale pellucida sono malattie familiare degenerative della cornea colpiscono uno o entrambi (96%) gli occhi nella maggior parte dei casi in modo asimmetrico. Rare (1 caso ogni 2000 soggetti) ma gravi causano un progressivo calo visivo che inizialmente può apparire come un astigmatismo.
Come già ricorda il nome, si tratta di una deformazione conica della struttura che si allunga dando un’ectasia ed un assottigliamento della stessa all’apice del cono. Questo produce una distorsione delle immagini sul piano retinico.
la patologia si manifesta attorno alla II decade di vita con una evoluzione che nella magior parte dei pazienti continua fino alla V-VI decade perpoi autolimitarsi. Il sesso maschile ha una lieve predominanza (54%).
È una patologia con origine familiare, ma si può presentare in associazione con alcune rare affezioni, incluse alcune malattie allergiche autoimmuni, la sindrome di Down, la sindrome di Ehlers-Danlos, la sindrome di Marfan, la distosi craniofacciale e la osteogenesi imperfetta (tutte condizioni di origine genetica).
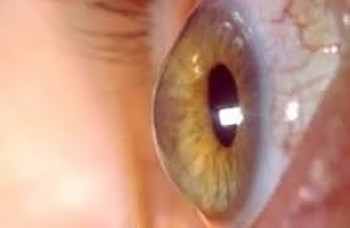
La curvatura irregolare creatasi modifica il potere refrattivo della cornea, producendo distorsioni delle immagini e una visione confusa sia da vicino che da lontano. Il paziente riferisce una progressiva riduzione dell’acuità visiva con comparsa o importante variazione dell’astigmatismo.
Si esegue una valutazione con la lampada a fessura che dimostra, ove già presenti, segni caratteristici della degenerazione conica ed ectasica:
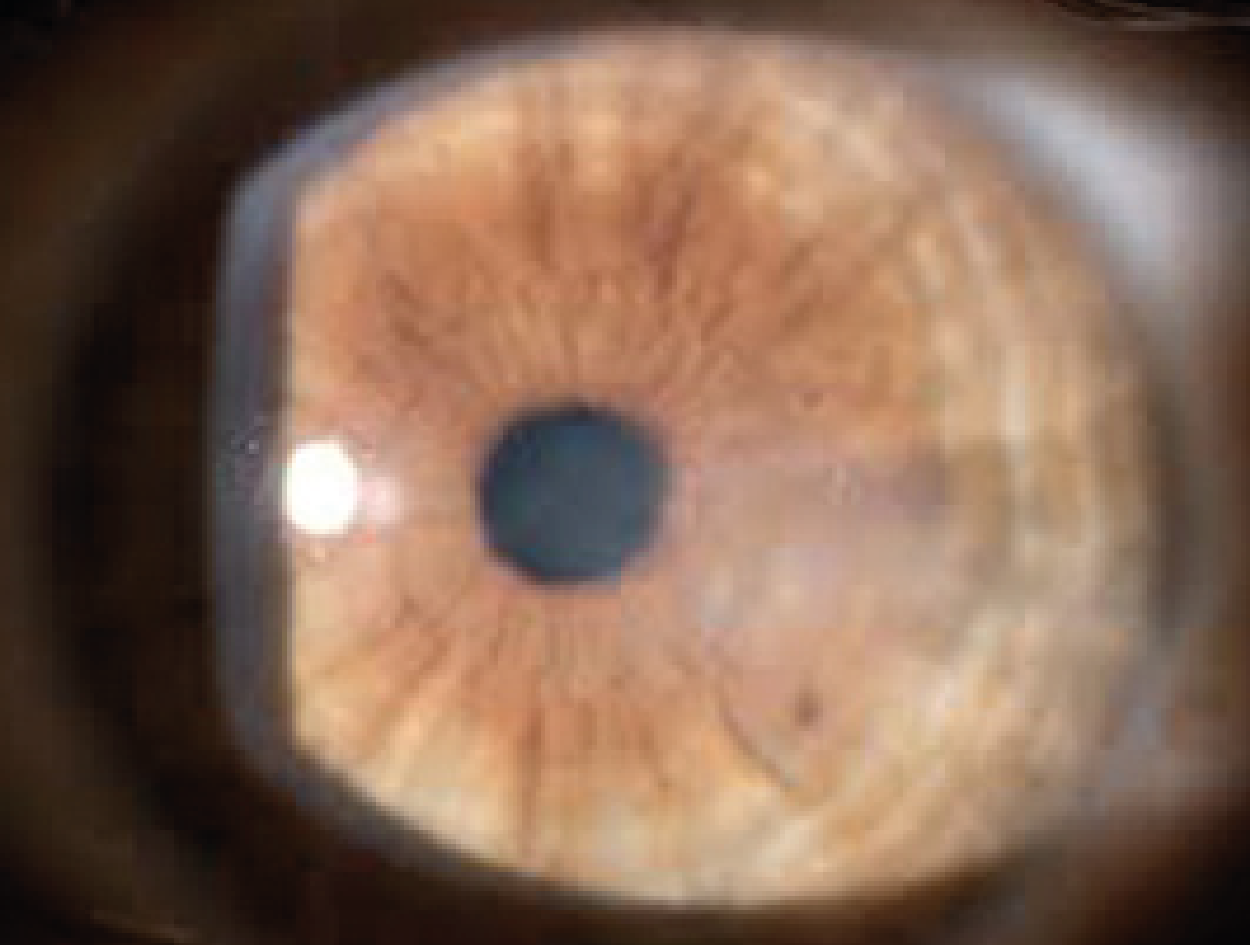
L’anello di Fleischer è un anello giallo-verdastro dovuto all’accumulo di emosiderina nelle cellule epiteliali basali opacità subepiteliali (che si formano da rotture della membrana di Bowman)
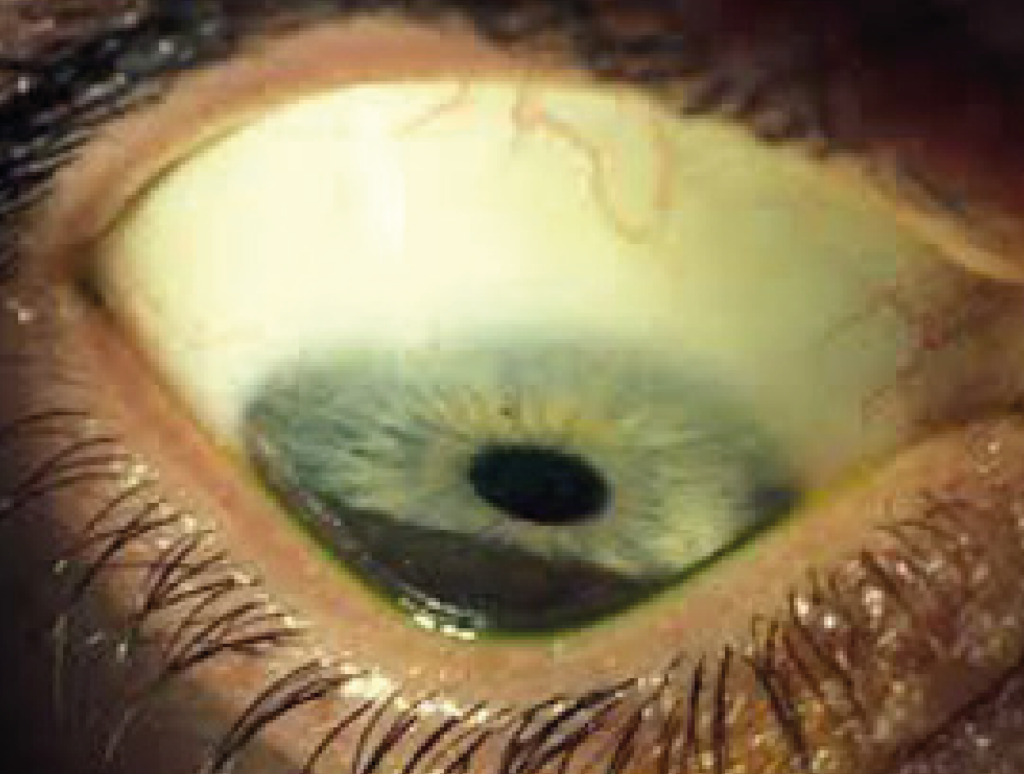
- Assottigliamento stromale maggiore a livello dell’apice del cono,
strie di Vogt
-Segno di Munson, che consiste nella deformazione della rima palpebrale inferiore da parte del cono e si visualizza facendo guardare verso il basso il soggetto
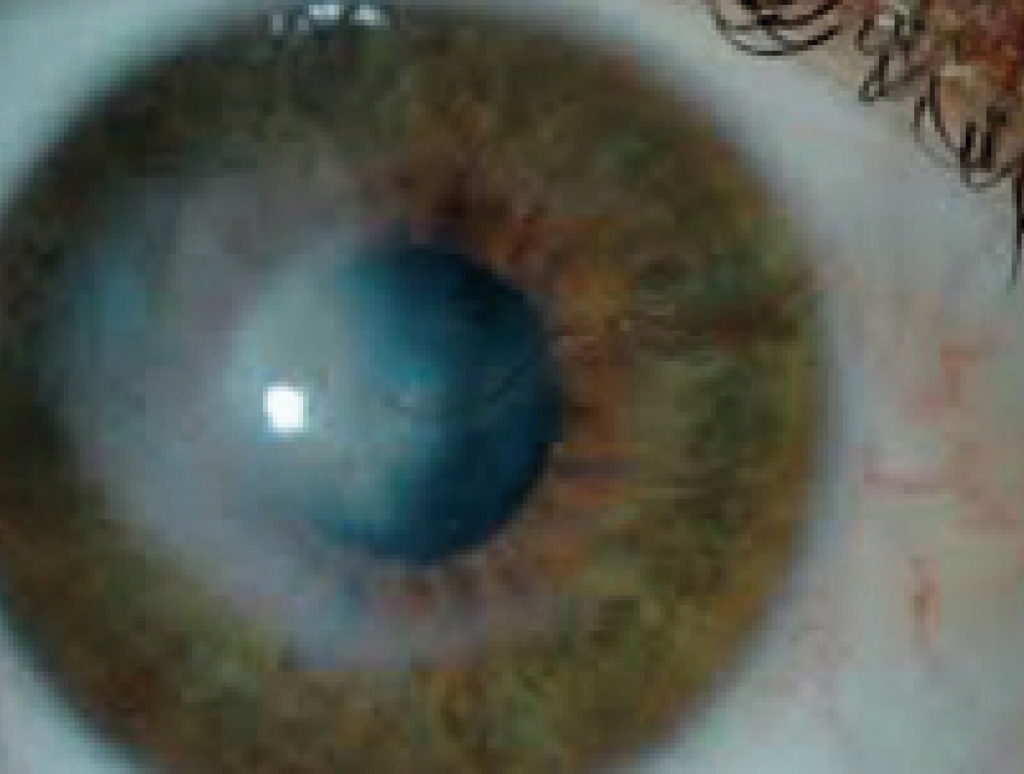
Apice corneale decentrato
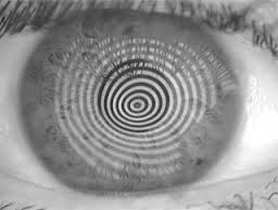
Si esegue un esame oculistico completo con quantificazione dell’acuità visiva “ottimizzata” con lenti.
Si devono eseguire gli esami strumentali specifici quali cheratoscopia (vedi immagine in basso), topografia corneale e pentacam (vedi sezione strumentazione diagnostica)
Stadiazione ed evoluzione
Il cheratocono può essere classificato secondo diversi parametri, a seconda della posizione, della morfologia, della curvatura corneale, dello spessore corneale.
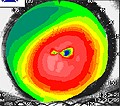
Iniziale
Il cheratocono lieve è caratterizzato da una topografia per la quale ogni punto della mappa è inferiore alle 45 diottrie. Il cono può essere posizionato in qualsiasi parte dell’occhio, anche se è prevalentemente presente nella parte inferiore, leggermente spostato verso la parte nasale.
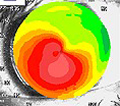
Intermedio
Il cheratocono moderato è caratterizzato da un contorno che si aggira intorno alle 55 diottrie o più. Permangono però delle gradazioni che rappresentano una differenza tra i vari livelli del cono.
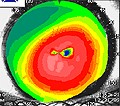
Avanzato
Nel caso del cheratocono avanzato tutto il contorno è superiore alle 55 diottrie. A differenza dell’intermedio, il KC avanzato non ha più differenze di livelli del cono, avendo una colorazione più omogenea che sta ad indicare un innalzamento complessivo.
STADIO – TIPO – DIOTTRIE
I LIEVE <45 D in entrambi i meridiani II MODERATO 45-52 D in entrambi i meridiani III AVANZATO >52 D in entrambi i meridiani
IV SEVERO >62 D in entrambi i meridiani
Stadio Sub-Clinico
Mire: regolari
Visus:10/10 (naturali o corretti)
Raggio Medio: uguale o lievemente inferiore a quello dell’occhio adelfo
Pachimetria: normale o lievemente inferiore
Cheratoscopia: ectasia fuori dalla zona ottica
I Grado
Mire: lievemente deformate
Asse oftalmometrico: obliquo
Raggio Medio: diminuito (in confronto all’altro occhio o a valore precedente)
Visus con occhiali: ridotto
Visus con LAC rigide: ottimo
Topografia: ectasia che interessa la zona ottica
II Grado
Mire: deformate
Raggio Medio: molto diminuito
Asse oftalmometrico: obliquo
Visus con occhiali: molto ridotto
Visus con LAC rigide: buono
Cheratoscopia: ectasia nella zona ottica
Cornea: trasparente/Strie di Vogt, lievemente ectasica
Pachimetria: 0,4-0,45 mm
III Grado
Mire: molto deformate
Raggio Medio: molto diminuito
Asse oftalmometrico: obliquo
Visus con occhiali: < 1/10
Visus con LAC rigide: discreto
Cheratoscopia: ectasia ampia decentrata
Cornea: Strie di Vogt, ectasia evidente, opacità stromali
Pachimetria: 0,35-0,40 mm
IV Grado
Mire: non determinabili
Raggio Medio: non valutabile
Visus con occhiali: < 1/20
Visus con LAC rigide: ridotto
Cheratoscopia: ectasia subtotale e alterata
Cornea: fibrosi apicale, ectasia ben evidente, opacità stromali
Pachimetria: 0,30-0,35 mm
Classificazione morfologica
STADIO – TIPO – DIAMETRO
STADIO – TIPO – DIAMETRO
I ROTONDO 5 mm – Cono piccolo circolare
II OVALE > di 5 mm – Cono ovale decentrato
III GLOBALE > di 6 mm – Il cono copre oltre il 75% della cornea
Classificazione basata sulla distanza dell'apice dal centro corneale
TIPO
I Centrale
II Paracentrale
III Periferico
IV Paralimbare (Distrofia Pellucida)
Classificazione di Amsler
GRADO
– I Astigmatismo obliquo con asimmetria delle mire all’oftalmometro di Javal
– II Astigmatismo più elevato con maggiore asimmetria delle mire all’oftalmometro. Assottigliamento evidente in cornea chiara
– III Astigmatismo non misurabile all’oftalmometro di Javal. Assottigliamento corneale marcato
– IV Oltre ai segni precedenti si associa la presenza di opacità corneali lineari
Proprio perché si tratta di una patologia evolutiva e perché i trattamenti “conservativi” possono essere eseguiti se i parametri corneali non arrivano a superare i II-III stadio i pazienti affetti da tale patologia devono sottoporsi a visita oculistica corredata dagli esami topografici e dal pentacam ogni 6 mesi .
Occhiali
Solo negli stadi iniziali o con cheratocono frusto di possiamo prescrivere lenti tempiali ottenendo un buon visus (8-10/10) Con l’evoluzione del cheratocono e l’incremento delle aberrazioni di alto ordine non correggibili con lenti oftalmiche tradizionali, aberrometriche o lenti a contatto morbide “usa e getta” l’unica soluzione è l’uso di lenti a contatto specifiche.
Lenti a contatto Rigide Gas Permeabili per cheratocono
Tali lenti “costruite su misura” per ogni paziente sulla base dei valori della topografia corneale e dell’aberrometria agiscono riducendo l’ectasia corneale dell’apice.
E’ importante che il paziente sia informato che queste lenti riducono sì la degenerazione conica dell’apice, ma non fermano l’evoluzione del cono ed i pazienti devono essere seguiti con controlli periodici al fine di fare diagnosi di evolutività o stabilità dello stesso.
Tali lenti sono state e sono tutt’oggi oggetto di evoluzione sia del materiale di cui sono costitutite sia d nuove geometrie. Può succedere che l’applicazione di lenti a contatto non ha successo in tutti i casi poiché, anche se si riesce a raggiungere un buon visus, a volte non sono ben tollerate e lo scarso comfort non permette di tenere le lenti per un’intera giornata lavorativa.
Il Cross-linking Corneale
Quando la patologia è evolutiva e l’evoluzione è dimostrata dagli esami strumentali il trattamento indicato è il Cross-linking corneale tradizionale o, ultima evoluzione è il cross-liking transepiteliale.
L’obiettivo che si ottiene con questa tecnica è quello di fermare l’evoluzione della patologia “irrobustendo” le fibre di collagene che compongono la cornea che sta sfiancandosi.
La tecnica transepiteliale è relativamente veloce (circa 30 minuti) meno dolorosa nel postoperatorio, in quanto non prevede la rimozione della parte più esterna dell’epitelio.
La tecnica, consiste nell’instillare delle gocce di vitamina B2 (riboflavina) ed esporre la cornea a una luce ultravioletta. La reazione chimica dei raggi UV-A che stimolano la riboflavina comporta un rafforzamento dei legami nel collagene corneale con un conseguente indurimento della cornea.
Il trapianto di cornea o Cheratoplastica
Quando lo stadio del cheratocono è molto evoluto e la cornea presenta gravi alterazioni strutturali che determinano la perdita della trasparenza tanto da ridurre acuità visiva a valori inaccettabili per le normali attività dell’individuo, l’unica soluzione è il trapianto corneale che a seconda della condizione clinica potrà essere lamellare o perforante.
L’intervento consiste nella sostituzione della cornea malata o di una sua parte con quella proveniente da un donatore. Si tratta di un trapianto di tessuto e non d’organo.
Il tessuto corneale è avascolare, cioè non è direttamente nutrito da vasi sanguigni e questo è determinante nello sviluppo della problematica del rigetto che è ovviamente meno frequente
A seconda dello strato corneale compromesso (stroma, endotelio) ci limitiamo al trapianto selettivo del tessuto patologico, lamellare anteriore profondo (DALK – Deep Anterior Lamellar Keratoplasty), in cui viene sostituita la sola porzione anteriore della cornea, senza perforare il bulbo oculare oppure un trapianto di solo endotelio corneale (DSAEK – Descemet Stripping Automated Endothelial Keratoplasty) lasciando intatta la porzione più superficiale sana.
Il trapianto di cornea a tutto spessore (PK o cheratoplastica perforante) viene tuttora riservato a tutti i casi in cui la compromissione corneale è intervenuta a tutti i livelli o ha determinato danni tissutali che non rendono praticabili le altre due tecniche descritte.
Patologie della cornea
Cos'è la cornea?
La cornea è una membrana trasparente, convessa che costituisce la porzione anteriore del bulbo oculare e rappresenta la lente più potente dell’apparato visivo. Assieme al cristallino forma il diottro oculare.
Ha uno spessore “normale” al centro di circa 520-540 µ e, vista anteriormente ha una forma leggermente ellittica con il diametro maggiore orizzontale lungo 11,7 mm contro i 10,6 mm del diametro minore e un diametro variabile dal limbus dov’è più spessa (0,67 mm) alla porzione centrale e più anteriore, la più sottile (0,52 mm).
Anteriormente è a contatto con l’ambiente esterno, le palpebre la proteggono ed il loro ammiccamento permette la distribuzione del film lacrimale prodotto dalle ghiandole lacrimali presenti sulla congiuntiva. Posteriormente è a contatto con l’umore acqueo che riempie e forma la camera anteriore.
Struttura istiologica
La cornea è costituita da cinque strati che dall’esterno all’interno sono:
- Epitelio corneale: pavimentoso composto non cheratinizzato. Consta di 5-6 strati che proteggono la superficie oculare dall’abrasione meccanica e formano una barriera permeabile;
- Membrana di Bowman o lamina elastica anteriore o membrana limitante anteriore: è un denso agglomerato di fibrille collagene;
- Sostanza propria o stroma o parenchima corneale, composta principalmente da fibre collagene. Costituisce la maggior parte della cornea; Tra una lamella e l’altra sono presenti dei caratteristici fibroblasti dalla forma dendritica, i cheratociti, che formano una sorta di rete e maglie larghe tra uno strato lamellare e il successivo. Lo spessore delle fibre collagene tende ad aumentare dalla zona centrale dirigendosi verso il limbo e l’età contribuisce all’ispessimento della cornea.
Gli strati lamellari permettono il passaggio della luce perché le loro fibrille sono più piccole della lunghezza d’onda della radiazione elettromagnetica che le attraversa, inoltre sono precisamente distanziate tra loro e la dispersione è ridotta al minimo dato che le fibrille collagene determinano interferenza distruttiva in tutte le direzioni, tranne in quella anteriore. - Membrana di Descemet o membrana elastica posteriore o membrana limitante posteriore;
- Endotelio: l’endotelio corneale è il quinto e più profondo strato della cornea. Si tratta di un singolo strato di cellule piatte e dalla forma esagonale, con nuclei allungati orizzontalmente. Le sue cellule sono strettamente adese tra loro grazie a interdigitazioni che si dipartono dalle porzioni laterali delle loro membrane plasmatiche, coadiuvate da giunzioni serrate e giunzioni comunicanti. Il loro citoplasma è basofilo a causa dello sviluppo del reticolo endoplasmatico rugoso, possiedono inoltre numerosi mitocondri, risultano cellule ad alta attività metabolica. Il suo compito è essenzialmente quello di fungere da filtro posteriore per gli strati superiori della cornea, è inoltre il principale responsabile della sua idratazione. Le sue cellule hanno una modesta capacità mitotica.
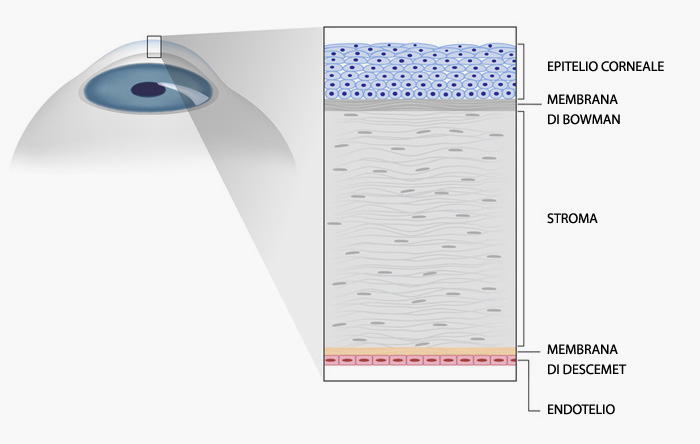
Agli strati precedentemente descritti se ne aggiunge un sesto, lo strato di Dua, di recente scoperta. Questo strato è localizzato nella parte posteriore della cornea, è spesso all’incirca 15 micron e può essere messo in evidenza solo mediante microscopia elettronica, previa insufflazione di aria nello spessore della cornea stessa.
La cornea è avascolare, riceve nutrimento dalle anse vascolari del limbus. Dalla parte interna l’endotelio corneale riceve nutrimento dall’umor acqueo contenuto nella camera anteriore. La cornea è molto innervata con piccoli rami mielinizzati del nervo oftalmico che in parte formano un plesso profondo sopra l’endotelio, in parte attraversano l’endotelio corneale e si proiettano perpendicolarmente nello stroma per poi formare un plesso al di sotto dell’epitelio corneale. Un ultimo plesso sottobasale è costituito da quei piccoli nervi che attraversano la membrana limitante anteriore e si proiettano come terminazioni nervose libere tra le cellule epiteliali; tali assoni presentano caratteristiche espansioni tondeggianti. A partire dall’entrata nello stroma le sottili terminazioni nervose diventano amieliniche. I nervi della cornea sono responsabili dei riflessi dell’ammiccamento e della stimolazione alla produzione del film lacrimale.
La funzione della cornea è quella di permettere il passaggio della luce verso le strutture interne dell’occhio, facendo convergere i raggi luminosi sul piano retinico e per precisione sulla fovea. Il suo potere medio di lente è di circa 43 diottrie, la superficie anteriore (convessa) ha un potere diottrico di +48 diottrie, mentre la faccia interna (concava) ha un potere diottrico di -5 diottrie. La cornea può essere sede di traumi, processi patologici ulcerativi (ulcera corneale), infiammatori (cheratiti), degenerativi (gerontoxon), iperplastico-degenerativi (pterigio), distrofici (cheratocono), tumori benigni o maligni etc. L’opacità corneale è un difetto di trasparenza a seguito di processi degenerativi, cheratiti o ulcere; a seconda del grado di opacamento si distinguono: la nubecola o il leucoma, l’acuità visiva è inversamente proporzionale all’entità dell’opacità corneale ed è tanto minore quanto più centrale è il leucoma. Al potere diottrico totale della cornea contribuisce in gran parte la sua forma, così che modificazioni della normale curvatura della superficie corneale determinano anomalie della focalizzazione delle immagini sulla retina.
Il cheratocono e la degenerazione marginale pellucida sono malattie familiare degenerative della cornea colpiscono uno o entrambi (96%) gli occhi.
Cheratiti
Sezione in aggiornamento.